Deck 12: Acids and Bases
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/65
العب
ملء الشاشة (f)
Deck 12: Acids and Bases
1
Identify the major ions present in an aqueous LiOH solution.
A)Li2+, O−, H−
B)Li+, OH−
C)LiO−, H+
D)Li+, O2−, H+
E)Li−, OH+
A)Li2+, O−, H−
B)Li+, OH−
C)LiO−, H+
D)Li+, O2−, H+
E)Li−, OH+
Li+, OH−
2
What is the name of a proton donor in an acid-base reaction?
A)Arrhenius acid
B)Arrhenius base
C)Brønsted acid
D)Brønsted base
E)Lewis base
A)Arrhenius acid
B)Arrhenius base
C)Brønsted acid
D)Brønsted base
E)Lewis base
Brønsted acid
3
The substance (CH3CH2)2NH is considered to be
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.
a weak base.
4
Which is the strongest acid?
A)HBrO4
B)HBr
C)HBrO2
D)HBrO
E)HBrO3
A)HBrO4
B)HBr
C)HBrO2
D)HBrO
E)HBrO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
5
Which is a strong base?
A)LiOH
B)CH3COOH
C)NH3
D)H3PO4
E)HClO2
A)LiOH
B)CH3COOH
C)NH3
D)H3PO4
E)HClO2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
6
Which is a strong acid?
A)Ba(OH)2
B)H3PO4
C)HC2H3O2
D)NaCl
E)HClO4
A)Ba(OH)2
B)H3PO4
C)HC2H3O2
D)NaCl
E)HClO4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
7
The substance HClO4 is considered to be
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
8
Which is present in all aqueous Brønsted acid solutions?
A)H2
B)H+
C)OH-
D)H2SO4
E)Cl-
A)H2
B)H+
C)OH-
D)H2SO4
E)Cl-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
9
Which is a weak base?
A)NH3
B)Ca(OH)2
C)Ba(OH)2
D)NaOH
E)CH3COOH
A)NH3
B)Ca(OH)2
C)Ba(OH)2
D)NaOH
E)CH3COOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
10
Which one of the following is a strong acid?
A)H2CO3
B)H2SO3
C)H2SO4
D)H3PO4
E)CH3COOH
A)H2CO3
B)H2SO3
C)H2SO4
D)H3PO4
E)CH3COOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
11
Which of the following is a strong base?
A)NH3
B)Ca(OH)2
C)Al(OH)3
D)B(OH)3
E)CH3OH
A)NH3
B)Ca(OH)2
C)Al(OH)3
D)B(OH)3
E)CH3OH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
12
Which is the strongest acid?
A)SO42−
B)H2SO3
C)H2SO4
D)HSO4−
E)HSO3−
A)SO42−
B)H2SO3
C)H2SO4
D)HSO4−
E)HSO3−

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
13
Which of the following is a weak acid?
A)H2SO4
B)HNO3
C)HF
D)HBr
E)HCl
A)H2SO4
B)HNO3
C)HF
D)HBr
E)HCl

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
14
Identify the major ions present in an aqueous HNO3 solution.
A)HN2+, O2−
B)OH−, NO3−
C)OH−, NO+
D)H+, N3−, O2−
E)H+, NO3−
A)HN2+, O2−
B)OH−, NO3−
C)OH−, NO+
D)H+, N3−, O2−
E)H+, NO3−

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
15
The substance NH3 is considered to be
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.
A)a weak acid.
B)a weak base.
C)a strong acid.
D)a strong base.
E)neither acidic nor basic.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
16
Which of the following is a strong acid?
A)H3PO4
B)HNO3
C)HF
D)CH3COOH
E)H2O
A)H3PO4
B)HNO3
C)HF
D)CH3COOH
E)H2O

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
17
Which is the strongest acid?
A)HBrO3
B)HClO
C)HBrO2
D)HBrO
E)HClO3
A)HBrO3
B)HClO
C)HBrO2
D)HBrO
E)HClO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
18
Which one of the following is a strong acid?
A)CH3COOH
B)H2SO3
C)NH3
D)H3PO4
E)HClO3
A)CH3COOH
B)H2SO3
C)NH3
D)H3PO4
E)HClO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
19
Complete the following reaction and identify the Brønsted acid.NaOH(aq) + HCl(aq) →
A)NaH(aq) + HOCl(aq); NaOH is the acid.
B)NaH(aq) + HOCl(aq); HCl is the acid.
C)NaCl(aq) + H2O(l); NaOH is the acid.
D)NaCl(aq) + H2O(l); HCl is the acid.
E)NaCl(aq) + H2O(l); NaCl is the acid.
A)NaH(aq) + HOCl(aq); NaOH is the acid.
B)NaH(aq) + HOCl(aq); HCl is the acid.
C)NaCl(aq) + H2O(l); NaOH is the acid.
D)NaCl(aq) + H2O(l); HCl is the acid.
E)NaCl(aq) + H2O(l); NaCl is the acid.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
20
What is the name of a proton acceptor in an acid-base reaction?
A)Arrhenius acid
B)Arrhenius base
C)Brønsted acid
D)Brønsted base
E)Lewis base
A)Arrhenius acid
B)Arrhenius base
C)Brønsted acid
D)Brønsted base
E)Lewis base

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
21
Which is the net ionic equation for the reaction between aqueous solutions of lithium hydroxide and hydrobromic acid? LiOH(aq) + HBr(aq) → H2O(l) + LiBr(aq)
A)LiOH(aq) → Li+(aq) + OH−(aq)
B)HBr(aq) → H+(aq) + Br−(aq)
C)H+(aq) + OH−(aq) → H2O(l)
D)Li+(aq) + Br−(aq) → LiBr(aq)
E)Li+(aq) + OH−(aq)+ H+(aq) + Br−(aq) → H2O(l) + LiBr(aq)
A)LiOH(aq) → Li+(aq) + OH−(aq)
B)HBr(aq) → H+(aq) + Br−(aq)
C)H+(aq) + OH−(aq) → H2O(l)
D)Li+(aq) + Br−(aq) → LiBr(aq)
E)Li+(aq) + OH−(aq)+ H+(aq) + Br−(aq) → H2O(l) + LiBr(aq)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
22
Which solution is the most acidic?
A)3 × 10−4 M H+
B)5 × 10−5 M H+
C)6 × 10−3 M H+
D)1 × 10−6 M H+
E)5 × 10−2 M H+
A)3 × 10−4 M H+
B)5 × 10−5 M H+
C)6 × 10−3 M H+
D)1 × 10−6 M H+
E)5 × 10−2 M H+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
23
What is the conjugate base of sulfuric acid?
A)HSO4−
B)H3O+
C)OH−
D)SO42−
E)H3SO4+
A)HSO4−
B)H3O+
C)OH−
D)SO42−
E)H3SO4+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
24
Which solution is the most acidic?
A)pH = 1.00
B)pH = 10.00
C)pH = 5.00
D)pH = 3.00
E)pH = 4.00
A)pH = 1.00
B)pH = 10.00
C)pH = 5.00
D)pH = 3.00
E)pH = 4.00

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
25
What is [OH−] for a solution at 25°C that has [H3O+] = 2.35 × 10−3 M?
A)4.26 × 10−5 M
B)2.35 ×10−11 M
C)4.26 × 10−12 M
D)2.35 × 10−17 M
E)2.35 ×10−3 M
A)4.26 × 10−5 M
B)2.35 ×10−11 M
C)4.26 × 10−12 M
D)2.35 × 10−17 M
E)2.35 ×10−3 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
26
What is the concentration of H+ in a 0.025 M HCl solution?
A)0
B)0.013 M
C)0.025 M
D)0.050 M
E)0.010 M
A)0
B)0.013 M
C)0.025 M
D)0.050 M
E)0.010 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
27
What is the conjugate base of NH3?
A)NH2
B)NH2+
C)NH2−
D)NH4
E)NH4+
A)NH2
B)NH2+
C)NH2−
D)NH4
E)NH4+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
28
What is the concentration of OH− in a 0.083 M NaOH solution?
A)0.083 M
B)1.21 × 10−13 M
C)8.30 × 10−16 M
D)7 M
E)8.30 × 1012 M
A)0.083 M
B)1.21 × 10−13 M
C)8.30 × 10−16 M
D)7 M
E)8.30 × 1012 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
29
Which solution is the most acidic?
A)1 × 10−4 M H+
B)1 × 10−9 M H+
C)1 × 10−3 M H+
D)1 × 10−7 M H+
E)1 × 10−10 M H+
A)1 × 10−4 M H+
B)1 × 10−9 M H+
C)1 × 10−3 M H+
D)1 × 10−7 M H+
E)1 × 10−10 M H+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
30
What is the name given to a substance that can act as a Brønsted acid or as a Brønsted base according to what it is reacting with?
A)hydrophilic
B)hydrophobic
C)amphoteric
D)isoprotic
E)isoelectronic
A)hydrophilic
B)hydrophobic
C)amphoteric
D)isoprotic
E)isoelectronic

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
31
A solution with a pH of 8.15 is
A)slightly acidic.
B)very basic.
C)neutral.
D)very acidic.
E)slightly basic.
A)slightly acidic.
B)very basic.
C)neutral.
D)very acidic.
E)slightly basic.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
32
Complete the following reaction and identify the Brønsted base: NaOH(aq) + HCl(aq) →
A)Na(aq) + HOCl(aq); NaOH is the base.
B)NaCl(aq) + OH−(aq); HCl is the base.
C)NaCl(aq) + OH−(aq); NaOH is the base.
D)H2O(l) + NaCl(aq); HCl is the base.
E)NaCl(aq)+ H2O(l); NaOH is the base.
A)Na(aq) + HOCl(aq); NaOH is the base.
B)NaCl(aq) + OH−(aq); HCl is the base.
C)NaCl(aq) + OH−(aq); NaOH is the base.
D)H2O(l) + NaCl(aq); HCl is the base.
E)NaCl(aq)+ H2O(l); NaOH is the base.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
33
What is the conjugate base of water?
A)H3O+
B)OH−
C)H3O
D)OH
E)H2O2
A)H3O+
B)OH−
C)H3O
D)OH
E)H2O2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
34
What is the pH of a 0.056 M HNO3 solution?
A)0.056
B)1.25
C)12.75
D)2.88
E)11.11
A)0.056
B)1.25
C)12.75
D)2.88
E)11.11

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
35
Which one of these responses is with regard to a 0.1 M solution of a weak acid HA?
A)[H+] > 0.1 M.
B)pH = 1.0
C)[H+] < [A-]
D)pH > 1.0
E)[OH-] > [H+]
A)[H+] > 0.1 M.
B)pH = 1.0
C)[H+] < [A-]
D)pH > 1.0
E)[OH-] > [H+]

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
36
What is [OH−] for a solution at 25°C that has [H3O+] = 8.23 × 10−2 M?
A)8.23 × 10−2 M
B)1.22 × 10−6 M
C)8.23 × 10−12 M
D)1.22 × 10−13 M
E)8.23 × 10−16 M
A)8.23 × 10−2 M
B)1.22 × 10−6 M
C)8.23 × 10−12 M
D)1.22 × 10−13 M
E)8.23 × 10−16 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
37
What is the H+ ion concentration in a 2.1 × 10−4 M Ca(OH)2 solution?
A)7.3 × 10−4 M
B)4.2 × 10−4 M
C)2.1 × 10−4 M
D)2.4 × 10−11 M
E)4.8 × 10−11 M
A)7.3 × 10−4 M
B)4.2 × 10−4 M
C)2.1 × 10−4 M
D)2.4 × 10−11 M
E)4.8 × 10−11 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
38
What is the conjugate acid of the acetate ion?
A)CH3O2−
B)COOH
C)HC2H3O2
D)H2O
E)CH4
A)CH3O2−
B)COOH
C)HC2H3O2
D)H2O
E)CH4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
39
Which solution is basic?
A)pH = 1.00
B)pH = 10.00
C)pH = 5.00
D)pH = 3.00
E)pH = 4.00
A)pH = 1.00
B)pH = 10.00
C)pH = 5.00
D)pH = 3.00
E)pH = 4.00

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
40
What is the concentration of OH− in a 1.0 × 10−3 M Ba(OH)2 solution?
A)0.50 × 10−3 M
B)1.0 × 10−3 M
C)2.0 × 10−3 M
D)1.0 × 10−2 M
E)3.3 × 10−4 M
A)0.50 × 10−3 M
B)1.0 × 10−3 M
C)2.0 × 10−3 M
D)1.0 × 10−2 M
E)3.3 × 10−4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
41
What is the conjugate acid of CO32− in the reaction below? CO32− + HSO4−  HCO3− + SO42−
HCO3− + SO42−
A)HCO3−
B)HSO4−
C)OH−
D)H3O+
E)SO42−
 HCO3− + SO42−
HCO3− + SO42−A)HCO3−
B)HSO4−
C)OH−
D)H3O+
E)SO42−

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
42
What is the pH of a solution in which [H+] is 1.22 × 10−4 M?
A)−3.914
B)1.220
C)3.914
D)4.000
E)4.086
A)−3.914
B)1.220
C)3.914
D)4.000
E)4.086

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
43
The pH of a Ba(OH)2 solution is 10.00.What is the H+ ion concentration of this solution?
A)4.0 × 10−11 M
B)1.6 × 10−10 M
C)1.3 × 10−5 M
D)1.0 × 10−10 M
E)10.00 M
A)4.0 × 10−11 M
B)1.6 × 10−10 M
C)1.3 × 10−5 M
D)1.0 × 10−10 M
E)10.00 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
44
Automobile batteries use 3.0 M H2SO4 as an electrolyte.How much 1.20 M NaOH will be needed to neutralize 225 mL of battery acid? H2SO4(aq) + 2NaOH(aq) → 2H2O(l) + Na2SO4(aq)
A)0.045 L
B)0.28 L
C)0.56 L
D)0.90 L
E)1.1 L
A)0.045 L
B)0.28 L
C)0.56 L
D)0.90 L
E)1.1 L

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
45
What volume of a 0.442 M NaOH solution is needed to neutralize 65.0 mL of a 0.296 M solution of HNO3?
A)8.71 mL
B)21.8 mL
C)43.5 mL
D)87.1 mL
E)174 mL
A)8.71 mL
B)21.8 mL
C)43.5 mL
D)87.1 mL
E)174 mL

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
46
What volume of a 0.452 M NaOH solution is needed to neutralize 85.0 mL of a 0.176 M solution of H2SO4?
A)218.3 mL
B)66.2 mL
C)38.4 mL
D)436.6 mL
E)33.1 mL
A)218.3 mL
B)66.2 mL
C)38.4 mL
D)436.6 mL
E)33.1 mL

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
47
In the reaction, HSO4
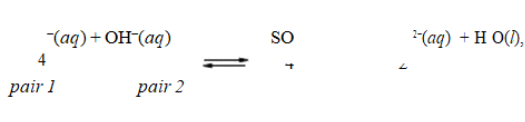 , the conjugate acid-base pairs are
, the conjugate acid-base pairs are
A)HSO − and SO 2−; H O and OH−.4 4
2
B)HSO4− and H3O+; SO42 − and OH−.
C)HSO4− and OH−; SO42 − and H2O.
D)HSO4− and H2O; OH − and SO42−.
E)HSO4− and OH−; SO42 − and H3O+.
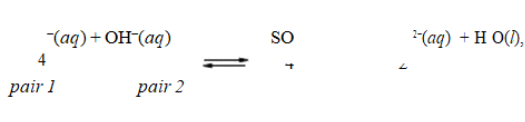 , the conjugate acid-base pairs are
, the conjugate acid-base pairs areA)HSO − and SO 2−; H O and OH−.4 4
2

B)HSO4− and H3O+; SO42 − and OH−.
C)HSO4− and OH−; SO42 − and H2O.
D)HSO4− and H2O; OH − and SO42−.
E)HSO4− and OH−; SO42 − and H3O+.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
48
What is the pH of a 0.050 M LiOH solution?
A)1.30
B)3.00
C)11.00
D)12.39
E)12.70
A)1.30
B)3.00
C)11.00
D)12.39
E)12.70

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
49
What is the conjugate base of HSO4− in the reaction below? CO32− + HSO4−  HCO3− + SO42−
HCO3− + SO42−
A)HSO4−
B)CO32−
C)OH−
D)H O+
3
E)SO42−
 HCO3− + SO42−
HCO3− + SO42−A)HSO4−
B)CO32−
C)OH−
D)H O+
3
E)SO42−

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
50
What is the [H3O+] for a solution at 25°C that has pOH = 5.640?
A)2.34 × 10−4 M
B)2.29 × 10−6 M
C)4.37 × 10−9 M
D)4.27 × 10−11 M
E)8.360 M
A)2.34 × 10−4 M
B)2.29 × 10−6 M
C)4.37 × 10−9 M
D)4.27 × 10−11 M
E)8.360 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
51
Identify the conjugate base of HPO42− in the reaction HCO3− + HPO42−  H2CO3 + PO43−
H2CO3 + PO43−
A)H2O
B)HCO3−
C)H2CO3
D)PO43−
E)None of these
 H2CO3 + PO43−
H2CO3 + PO43−A)H2O
B)HCO3−
C)H2CO3
D)PO43−
E)None of these

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
52
During a titration, it is found that 53.5 mL of a solution of NaOH is needed to neutralize a solution that contains 1.86 g of HCl.What is the concentration of the NaOH solution?
A)0.051 M
B)0.686 M
C)1.05 M
D)0.035 M
E)0.953 M
A)0.051 M
B)0.686 M
C)1.05 M
D)0.035 M
E)0.953 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
53
What is the pH of a 0.056 M HNO3 solution?
A)0.056
B)1.25
C)12.75
D)2.88
E)11.11
A)0.056
B)1.25
C)12.75
D)2.88
E)11.11

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
54
What is the [H+] in a solution with a pH of 5.63?
A)2.344 × 10−6 M H+
B)2.344 × 10−5 M H+
C)5.63 M H+
D)2.3 × 10−6 M H+
E)2.3 × 10−5 M H+
A)2.344 × 10−6 M H+
B)2.344 × 10−5 M H+
C)5.63 M H+
D)2.3 × 10−6 M H+
E)2.3 × 10−5 M H+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
55
A standard solution of 0.243 M NaOH was used to determine the concentration of a hydrochloric acid solution.If 46.33 mL of NaOH is needed to neutralize 10.00 mL of the acid, what is the molar concentration of the acid in the original solution?
A)0.243 M
B)0.200 M
C)1.13 M
D)0.563 M
E)0.0313 M
A)0.243 M
B)0.200 M
C)1.13 M
D)0.563 M
E)0.0313 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
56
A 34.62-mL of 0.1510 M NaOH was needed to neutralize 50.0 mL of an H2SO4 solution.What is the concentration of the original sulfuric acid solution?
A)0.0229 M
B)0.218 M
C)0.0523 M
D)0.209 M
E)0.105 M
A)0.0229 M
B)0.218 M
C)0.0523 M
D)0.209 M
E)0.105 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
57
Vinegar is a solution of acetic acid, HC2H3O2 , dissolved in water.A 5.54-g sample of vinegar was neutralized by 30.10 mL of 0.100 M NaOH.What is the percent by weight of acetic acid in the vinegar?
A)0.0543%
B)1.08%
C)3.26%
D)5.43%
E)9.23%
A)0.0543%
B)1.08%
C)3.26%
D)5.43%
E)9.23%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
58
What is the pOH of a 0.0085 M KOH solution?
A)2.07
B)4.85
C)9.15
D)11.93
E)0.0085
A)2.07
B)4.85
C)9.15
D)11.93
E)0.0085

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
59
What is the pH of a 0.014 M Ca(OH)2 solution?
A)1.85
B)1.55
C)12.15
D)12.45
E)15.85
A)1.85
B)1.55
C)12.15
D)12.45
E)15.85

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
60
What is the pOH of a 0.025 M HI solution?
A)0.025
B)0.94
C)1.60
D)12.40
E)10.31
A)0.025
B)0.94
C)1.60
D)12.40
E)10.31

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
61
Which one of these salts will form an acidic solution upon dissolving in water?
A)LiBr
B)NaF
C)NH4Br
D)KOH
E)NaCN
A)LiBr
B)NaF
C)NH4Br
D)KOH
E)NaCN

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
62
Which one of these salts will form a basic solution upon dissolving in water?
A)NaCl
B)NaNO2
C)NH4NO3
D)KBr
E)AlCl3
A)NaCl
B)NaNO2
C)NH4NO3
D)KBr
E)AlCl3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
63
Which pair of substances could form a buffered aqueous solution?
A)HCl, NaCl
B)HNO3, NaNO3
C)H3PO4, NaH2PO4
D)H2SO4, CH3COOH
E)NH3, NaOH
A)HCl, NaCl
B)HNO3, NaNO3
C)H3PO4, NaH2PO4
D)H2SO4, CH3COOH
E)NH3, NaOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
64
Which pair of substances is capable of forming a buffer in aqueous solution?
A)H3PO4, Na3PO3
B)HNO3, NaNO3
C)HCl, NaCl
D)H2CO3, NaNO2
E)CH3COOH, CH3COONa
A)H3PO4, Na3PO3
B)HNO3, NaNO3
C)HCl, NaCl
D)H2CO3, NaNO2
E)CH3COOH, CH3COONa

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck
65
Which pair of substances cannot form a buffered aqueous solution?
A)HCN and KCN
B)NH3 and (NH4)2SO4
C)HNO3 and NaNO3
D)HF and NaF
E)HNO2 and NaNO2
A)HCN and KCN
B)NH3 and (NH4)2SO4
C)HNO3 and NaNO3
D)HF and NaF
E)HNO2 and NaNO2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 65 في هذه المجموعة.
فتح الحزمة
k this deck








