Deck 8: Thermochemistry: Chemical Energy
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/163
العب
ملء الشاشة (f)
Deck 8: Thermochemistry: Chemical Energy
1
Which depends only on the initial and final state?
A)q
B)w
C)q + w
D)q - w
A)q
B)w
C)q + w
D)q - w
q + w
2
Which is a measure of the sum of the kinetic and potential energies of each particle in the system?
A)E,the internal energy
B)G,the Gibbs free energy
C)H,the enthalpy
D)T,the temperature
A)E,the internal energy
B)G,the Gibbs free energy
C)H,the enthalpy
D)T,the temperature
E,the internal energy
3
Which of the following is not a type of energy or energy transfer?
A)chemical energy
B)heat
C)temperature
D)work
A)chemical energy
B)heat
C)temperature
D)work
temperature
4
An ideal gas expands into a vacuum (external pressure = 0)without gaining or losing heat.For this expansion
A)ΔE increases.
B)ΔE does not change.
C)ΔE decreases.
D)ΔE = TΔS
A)ΔE increases.
B)ΔE does not change.
C)ΔE decreases.
D)ΔE = TΔS

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
5
The nutritional calorie (abbreviated Cal)is equal to
A)1 mcal.
B)4)184 J.
C)4)184 cal.
D)1 kcal.
A)1 mcal.
B)4)184 J.
C)4)184 cal.
D)1 kcal.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
6
A process is carried out at constant pressure.Given that 0 > ΔH > ΔE,
A)the system absorbs heat and expands during the process.
B)the system absorbs heat and contracts during the process.
C)the system loses heat and expands during the process.
D)the system loses heat and contracts during the process.
A)the system absorbs heat and expands during the process.
B)the system absorbs heat and contracts during the process.
C)the system loses heat and expands during the process.
D)the system loses heat and contracts during the process.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
7
The first law of thermodynamics
A)defines chemical energy.
B)defines entropy.
C)is a statement of conservation of energy.
D)provides a criterion for the spontaneity of a reaction.
A)defines chemical energy.
B)defines entropy.
C)is a statement of conservation of energy.
D)provides a criterion for the spontaneity of a reaction.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
8
For a process at constant volume,
A)q = 0,w = 0,and ΔE = 0.
B)w = 0 and ΔE = q.
C)w = 0 and ΔH = q.
D)w = 0 and ΔE = ΔH.
A)q = 0,w = 0,and ΔE = 0.
B)w = 0 and ΔE = q.
C)w = 0 and ΔH = q.
D)w = 0 and ΔE = ΔH.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
9
Calculate the work energy,w,gained or lost by the system when a gas expands from 15 L to 35 L against a constant external pressure of 1.5 atm.[1 L ∙ atm = 101 J]
A)-5.3 kJ
B)-3.0 kJ
C)+3.0 kJ
D)+5.3 kJ
A)-5.3 kJ
B)-3.0 kJ
C)+3.0 kJ
D)+5.3 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
10
A slice of cheese pizza has a caloric content of 150 Cal.If this energy could be used to power a 2500 Watt microwave oven,how many minutes could the microwave oven be operated?
A)1)0 min
B)4)2 min
C)11 min
D)15 min
A)1)0 min
B)4)2 min
C)11 min
D)15 min

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
11
A process is carried out at constant pressure.Given that ΔE is positive and ΔH is negative,
A)the system absorbs heat and expands during the process.
B)the system absorbs heat and contracts during the process.
C)the system loses heat and expands during the process.
D)the system loses heat and contracts during the process.
A)the system absorbs heat and expands during the process.
B)the system absorbs heat and contracts during the process.
C)the system loses heat and expands during the process.
D)the system loses heat and contracts during the process.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
12
Most chemical reactions are carried out in one of two ways:
I.in an open vessel at constant atmospheric pressure
II.in a closed vessel
Which is true?
A)ΔH = q for condition I and ΔE = q for condition II
B)ΔE = q for condition I and ΔH = q for condition II
C)ΔH = w for condition I and ΔE = w for condition II
D)ΔE = w for condition I and ΔH = w for condition II
I.in an open vessel at constant atmospheric pressure
II.in a closed vessel
Which is true?
A)ΔH = q for condition I and ΔE = q for condition II
B)ΔE = q for condition I and ΔH = q for condition II
C)ΔH = w for condition I and ΔE = w for condition II
D)ΔE = w for condition I and ΔH = w for condition II

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
13
For most chemical reactions
A)ΔH is much larger than ΔE.
B)ΔE is much larger than ΔH.
C)ΔH is equal to ΔE.
D)the difference between ΔH and ΔE is very small.
A)ΔH is much larger than ΔE.
B)ΔE is much larger than ΔH.
C)ΔH is equal to ΔE.
D)the difference between ΔH and ΔE is very small.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
14
What is expected when the reaction shown below takes place in a thermally-insulated container outfitted with a movable piston at a constant atmospheric pressure of 1 atm?
2 C2H6(g)+ 7 O2(g)→ 4 CO2(g)+ 6 H2O(g)
A)Volume will decrease and work will be done by the system.
B)Volume will decrease and work will be done on the system.
C)Volume will increase and work will be done by the system.
D)volume will decrease and work will be done on the system.
2 C2H6(g)+ 7 O2(g)→ 4 CO2(g)+ 6 H2O(g)
A)Volume will decrease and work will be done by the system.
B)Volume will decrease and work will be done on the system.
C)Volume will increase and work will be done by the system.
D)volume will decrease and work will be done on the system.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
15
Which of the following is not a state function?
A)altitude
B)heat
C)internal energy
D)volume
A)altitude
B)heat
C)internal energy
D)volume

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
16
At 298 K the average kinetic energy is the same for H2,He,and N2.The gas with the highest average velocity is
A)H2.
B)He.
C)N2.
D)All have the same average velocity.
A)H2.
B)He.
C)N2.
D)All have the same average velocity.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
17
For a system at constant pressure,12,400 calories of heat are released.This quantity of heat is equivalent to
A)1)92 × 10-5 J.
B)2)96 × 103 J.
C)1)24 × 104 J.
D)5)19 × 104 J.
A)1)92 × 10-5 J.
B)2)96 × 103 J.
C)1)24 × 104 J.
D)5)19 × 104 J.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
18
In which case is the work done on the system always positive?
A)ΔE > 0
B)ΔV > 0
C)ΔV = 0
D)ΔV < 0
A)ΔE > 0
B)ΔV > 0
C)ΔV = 0
D)ΔV < 0

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
19
For a process at constant pressure,
A)ΔE = w and q = 0.
B)ΔE = q and w = 0.
C)ΔE = ΔH.
D)ΔH = q.
A)ΔE = w and q = 0.
B)ΔE = q and w = 0.
C)ΔE = ΔH.
D)ΔH = q.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
20
For a particular process that is carried out at constant pressure,q = 125 kJ and w = -15 kJ.Therefore,
A)ΔE = 110 kJ and ΔH = 125 kJ.
B)ΔE = 125 kJ and ΔH = 110 kJ.
C)ΔE = 125 kJ and ΔH = 140 kJ.
D)ΔE = 140 kJ and ΔH = 125 kJ.
A)ΔE = 110 kJ and ΔH = 125 kJ.
B)ΔE = 125 kJ and ΔH = 110 kJ.
C)ΔE = 125 kJ and ΔH = 140 kJ.
D)ΔE = 140 kJ and ΔH = 125 kJ.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
21
At constant pressure,the combustion of 5.00 g of C2H6(g)releases 259 kJ of heat.What is ΔH for the reaction given below?
2 C2H6(g)+ 7 O2(g)→ 4 CO2(g)+ 6 H2O(l)
A)-43.2 kJ
B)-779 kJ
C)-1560 kJ
D)-3120 kJ
2 C2H6(g)+ 7 O2(g)→ 4 CO2(g)+ 6 H2O(l)
A)-43.2 kJ
B)-779 kJ
C)-1560 kJ
D)-3120 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
22
Find ΔE° for the reaction below if the process is carried out at a constant pressure of 1.00 atm and ΔV (the volume change)= -24.5 L.(1 L ∙ atm = 101 J)
2 CO(g)+ O2 (g)→ 2 CO2(g)ΔH° = -566.kJ
A)+2.47 kJ
B)-2.47 kJ
C)-564 kJ
D)-568 kJ
2 CO(g)+ O2 (g)→ 2 CO2(g)ΔH° = -566.kJ
A)+2.47 kJ
B)-2.47 kJ
C)-564 kJ
D)-568 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
23
For the reaction I2(g)→ I2(s),ΔH° = -62.4 kJ at 25°C.Based on these data,at 25°C
A)ΔH°vap = -62.4 kJ/mol.
B)ΔH°vap = 62.4 kJ/mol.
C)ΔH°sub = -62.4 kJ/mol.
D)ΔH°sub = 62.4 kJ/mol.
A)ΔH°vap = -62.4 kJ/mol.
B)ΔH°vap = 62.4 kJ/mol.
C)ΔH°sub = -62.4 kJ/mol.
D)ΔH°sub = 62.4 kJ/mol.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
24
At constant pressure for which of the reactions shown below should ΔH° be greater than ΔE° ?
I.2 SO2(g)+ O2(g)→ 2 SO3(g)
II.C3H8(g)+ 5 O2(g)→ 3 CO2(g)+ 4 H2O(l)
III.H2(g)+ Cl2(g)→ 2 HCl(g)
IV.N2O4(g)→ 2 NO2(g)
A)I)
B)III.
C)IV.
D)II.and IV.
I.2 SO2(g)+ O2(g)→ 2 SO3(g)
II.C3H8(g)+ 5 O2(g)→ 3 CO2(g)+ 4 H2O(l)
III.H2(g)+ Cl2(g)→ 2 HCl(g)
IV.N2O4(g)→ 2 NO2(g)
A)I)
B)III.
C)IV.
D)II.and IV.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
25
The heat of vaporization of water at 100°C is 40.66 kJ/mol.Calculate the quantity of heat that is absorbed/released when 5.00 g of steam condenses to liquid water at 100°C.
A)11.3 kJ of heat are absorbed.
B)11.3 kJ of heat are released.
C)147 kJ of heat are absorbed.
D)147 kJ of heat are released.
A)11.3 kJ of heat are absorbed.
B)11.3 kJ of heat are released.
C)147 kJ of heat are absorbed.
D)147 kJ of heat are released.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
26
At a constant pressure of 1.50 atm what is the enthalpy change ΔH for a reaction where the internal energy change ΔE is 58.0 kJ and the volume increase is 12.6 L? (1 L·atm = 101.325 J. )
A)39.1 kJ
B)56.1 kJ
C)59.9 kJ
D)76.9 kJ
A)39.1 kJ
B)56.1 kJ
C)59.9 kJ
D)76.9 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
27
Which is the most exothermic reaction?
A)CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(g)
B)CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(l)
C)CO2(g)+ 2 H2O(l)→CH4(g)+ 2 O2(g)
D)CO2(g)+ 2 H2O(g)→CH4(g)+ 2 O2(g)
A)CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(g)
B)CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(l)
C)CO2(g)+ 2 H2O(l)→CH4(g)+ 2 O2(g)
D)CO2(g)+ 2 H2O(g)→CH4(g)+ 2 O2(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
28
Under thermodynamic standard state conditions the element oxygen occurs as
A)O(g)
B)O2(g)
C)O2(l)
D)O3(g)
A)O(g)
B)O2(g)
C)O2(l)
D)O3(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
29
The enthalpy of fusion,or heat of fusion (ΔHfusion),of water is positive and corresponds to which physical change?
A)H2O(g)→ H2O(s)
B)H2O(l)→ H2O(s)
C)H2O(s)→ H2O(l)
D)H2O(s)→ H2O(g)
A)H2O(g)→ H2O(s)
B)H2O(l)→ H2O(s)
C)H2O(s)→ H2O(l)
D)H2O(s)→ H2O(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
30
How much heat is absorbed/released when 20.00 g of NH3(g)reacts in the presence of excess O2(g)to produce NO(g)and H2O(l)according to the following chemical equation?
4 NH3(g)+ 5 O2(g)→ 4 NO(g)+ 6 H2O(l)ΔH° = +1168 kJ
A)342.9 kJ of heat are absorbed.
B)342.9 kJ of heat are released.
C)1372 kJ of heat are absorbed.
D)1372 kJ of heat are released.
4 NH3(g)+ 5 O2(g)→ 4 NO(g)+ 6 H2O(l)ΔH° = +1168 kJ
A)342.9 kJ of heat are absorbed.
B)342.9 kJ of heat are released.
C)1372 kJ of heat are absorbed.
D)1372 kJ of heat are released.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
31
Calculate the total quantity of heat required to convert 25.0 g of liquid CCl4(l)from 25.0°C to gaseous CCl4 at 76.8°C (the normal boiling point for CCl4)? The specific heat of CCl4(l)is
0)857 J/(g·°C),its heat of fusion is 3.27 kJ/mol,and its heat of vaporization is 29.82 kJ/mol.
A)1)11 kJ
B)1)64 kJ
C)5)96 kJ
D)6)49 kJ
0)857 J/(g·°C),its heat of fusion is 3.27 kJ/mol,and its heat of vaporization is 29.82 kJ/mol.
A)1)11 kJ
B)1)64 kJ
C)5)96 kJ
D)6)49 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
32
At 1 atm pressure the heat of sublimation of gallium is 277 kJ/mol and the heat of vaporization is 271 kJ/mol.How much heat is required to melt 1.50 mol of gallium at 1 atm pressure?
A)6 kJ
B)9 kJ
C)268 kJ
D)271 kJ
A)6 kJ
B)9 kJ
C)268 kJ
D)271 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
33
When 2.000 moles of H2(g)reacts with 1.000 mol of O2(g)to form 2.000 mol of H2O(l)at 25°C and a constant pressure of 1.00 atm.If 136.6 kJ of heat are released during this reaction,and PΔV is equal to -7.400 kJ,then
A)ΔH° = +136.6 kJ and ΔE° = +144.0 kJ.
B)ΔH° = +136.6 kJ and ΔE° = +129.2 kJ.
C)ΔH° = -136.6 kJ and ΔE° = -129.2 kJ.
D)ΔH° = -136.6 kJ and ΔE° = -144.0 kJ.
A)ΔH° = +136.6 kJ and ΔE° = +144.0 kJ.
B)ΔH° = +136.6 kJ and ΔE° = +129.2 kJ.
C)ΔH° = -136.6 kJ and ΔE° = -129.2 kJ.
D)ΔH° = -136.6 kJ and ΔE° = -144.0 kJ.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
34
When 0.250 mol of CH4(g)reacts with excess Cl2(g)at constant pressure according to the chemical equation shown below,177 kJ of heat are released.Calculate the value of ΔH for this reaction,as written.
2 CH4(g)+ 3 Cl2(g)→ 2 CHCl3(l)+ 3 H2(g)ΔH = ?
A)-1420 kJ
B)-708 kJ
C)+708 kJ
D)+1420 kJ
2 CH4(g)+ 3 Cl2(g)→ 2 CHCl3(l)+ 3 H2(g)ΔH = ?
A)-1420 kJ
B)-708 kJ
C)+708 kJ
D)+1420 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
35
When 1.00 mol of benzene is vaporized at a constant pressure of 1.00 atm and at its normal boiling point of 80.1°C,33.9 kJ are absorbed and PΔV for the vaporization process is equal to 2.90 kJ,then
A)ΔE = 31.0 kJ and ΔH = 33.9 kJ.
B)ΔE = 36.8 kJ and ΔH = 33.9 kJ.
C)ΔE = 33.9 kJ and ΔH = 31.0 kJ.
D)ΔE = 33.9 kJ and ΔH = 36.8 kJ.
A)ΔE = 31.0 kJ and ΔH = 33.9 kJ.
B)ΔE = 36.8 kJ and ΔH = 33.9 kJ.
C)ΔE = 33.9 kJ and ΔH = 31.0 kJ.
D)ΔE = 33.9 kJ and ΔH = 36.8 kJ.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
36
How much heat is transferred per mole of NH3(g)formed in the reaction shown below?
N2(g)+ 3 H2(g)→ 2 NH3(g)ΔH° = - 92.2 kJ
A)92.2 kJ
B)46.1 kJ
C)30.7 kJ
D)15.4 kJ
N2(g)+ 3 H2(g)→ 2 NH3(g)ΔH° = - 92.2 kJ
A)92.2 kJ
B)46.1 kJ
C)30.7 kJ
D)15.4 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
37
At 25°C the heat of fusion of aluminum is 10.6 kJ/mol and the heat of sublimation is 326.4 kJ/mol.What is the heat of vaporization of aluminum at 25°C?
A)158.2 kJ/mol
B)168.5 kJ/mol
C)315.8 kJ/mol
D)337.0 kJ/mol
A)158.2 kJ/mol
B)168.5 kJ/mol
C)315.8 kJ/mol
D)337.0 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
38
For an explosion in an open vessel,one would expect
A)ΔH to be positive and ΔE to be less than ΔH.
B)ΔH to be positive and ΔE to be greater than ΔH.
C)ΔH to be negative and ΔE to be less than ΔH.
D)ΔH to be negative and ΔE to be greater than ΔH.
A)ΔH to be positive and ΔE to be less than ΔH.
B)ΔH to be positive and ΔE to be greater than ΔH.
C)ΔH to be negative and ΔE to be less than ΔH.
D)ΔH to be negative and ΔE to be greater than ΔH.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
39
At constant pressure for the reaction shown below,what can be said about PΔV and ΔE?
N2(g)+ 3 H2(g)→ 2 NH3(g)ΔH° = - 92.2 kJ
A)PΔV > 0 and ΔE > -92.2 kJ
B)PΔV > 0 and ΔE < -92.2 kJ
C)PΔV < 0 and ΔE > -92.2 kJ
D)PΔV < 0 and ΔE < -92.2 kJ
N2(g)+ 3 H2(g)→ 2 NH3(g)ΔH° = - 92.2 kJ
A)PΔV > 0 and ΔE > -92.2 kJ
B)PΔV > 0 and ΔE < -92.2 kJ
C)PΔV < 0 and ΔE > -92.2 kJ
D)PΔV < 0 and ΔE < -92.2 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
40
How much heat is absorbed when 30.00 g of C(s)reacts in the presence of excess SO2(g)to produce CS2(l)and CO(g)according to the following chemical equation?
5 C(s)+ 2 SO2(g)→ CS2(l)+ 4 CO(g)ΔH° = +239.9 kJ
A)119.9 kJ
B)239.9 kJ
C)599.2 kJ
D)1439 kJ
5 C(s)+ 2 SO2(g)→ CS2(l)+ 4 CO(g)ΔH° = +239.9 kJ
A)119.9 kJ
B)239.9 kJ
C)599.2 kJ
D)1439 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
41
Given: 4 NO2(g)+ O2(g)→ 2 N2O5(g)ΔH° = -110.2 kJ
Find ΔH° for N2O5(g)→ 2 NO2(g)+ 1/2 O2(g).
A)-220.4 kJ
B)-55.1 kJ
C)55.1 kJ
D)220.4 kJ
Find ΔH° for N2O5(g)→ 2 NO2(g)+ 1/2 O2(g).
A)-220.4 kJ
B)-55.1 kJ
C)55.1 kJ
D)220.4 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
42
Given: S (s)+ O2 (g)→ SO2 (g)ΔH° = -296.1 kJ
2 SO3 (g)→ 2 SO2 (g)+ O2 (g)ΔH° = 198.2 kJ
Find ΔH° for : 2 S(s)+ 3 O2(g)→ 2 SO3(g)
A)-790.4 kJ
B)-394.0 kJ
C)-97.9 kJ
D)+97.9 kJ
2 SO3 (g)→ 2 SO2 (g)+ O2 (g)ΔH° = 198.2 kJ
Find ΔH° for : 2 S(s)+ 3 O2(g)→ 2 SO3(g)
A)-790.4 kJ
B)-394.0 kJ
C)-97.9 kJ
D)+97.9 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
43
Coal gasification can be represented by the equation:
2 C(s)+ 2 H2O(g)→ CH4(g)+ CO2(g)ΔH = ?
Use the following information to find ΔH for the reaction above.
CO(g)+ H2(g)→ C(s)+ H2O(g)ΔH = -131 kJ
CO(g)+ H2O(g)→ CO2(g)+ H2(g)ΔH = -41 kJ
CO(g)+ 3 H2(g)→ CH4(g)+ H2O(g)ΔH = -206 kJ
A)15 kJ
B)116 kJ
C)-116 kJ
D)-372 kJ
2 C(s)+ 2 H2O(g)→ CH4(g)+ CO2(g)ΔH = ?
Use the following information to find ΔH for the reaction above.
CO(g)+ H2(g)→ C(s)+ H2O(g)ΔH = -131 kJ
CO(g)+ H2O(g)→ CO2(g)+ H2(g)ΔH = -41 kJ
CO(g)+ 3 H2(g)→ CH4(g)+ H2O(g)ΔH = -206 kJ
A)15 kJ
B)116 kJ
C)-116 kJ
D)-372 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
44
It takes 11.2 kJ of energy to raise the temperature of 145 g of benzene from 25.0°C to 70.0°C.What is the specific heat of benzene?
A)1)10 J/(g ∙ °C)
B)1)72 J/(g ∙ °C)
C)3)48 J/(g ∙ °C)
D)5)41 J/(g ∙ °C)
A)1)10 J/(g ∙ °C)
B)1)72 J/(g ∙ °C)
C)3)48 J/(g ∙ °C)
D)5)41 J/(g ∙ °C)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
45
Which is expected to have the most negative standard enthalpy of formation?
A)H2(g)
B)O2(g)
C)H2O(g)
D)H2O(l)
A)H2(g)
B)O2(g)
C)H2O(g)
D)H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
46
Sodium metal reacts with water to produce hydrogen gas and sodium hydroxide according to the chemical equation shown below.When 0.0300 mol of Na is added to 100.00 g of water,the temperature of the resulting solution rises from 25.00°C to 37.90°C.If the specific heat of the solution is
4)18 J/(g ∙ °C),calculate ΔH for the reaction,as written.
2 Na(s)+ 2 H2O(l)→ 2 NaOH(aq)+ H2(g)ΔH = ?
A)-5.41 kJ
B)-90.0 kJ
C)-180 kJ
D)-362 kJ
4)18 J/(g ∙ °C),calculate ΔH for the reaction,as written.
2 Na(s)+ 2 H2O(l)→ 2 NaOH(aq)+ H2(g)ΔH = ?
A)-5.41 kJ
B)-90.0 kJ
C)-180 kJ
D)-362 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
47
When 50.0 mL of 0.400 M Ca(NO3)2 is added to 50.0 mL of 0.800 M NaF,CaF2 precipitates,as shown in the net ionic equation below.The initial temperature of both solutions is 25.00°C.Assuming that the reaction goes to completion,and that the resulting solution has a mass of 100.00 g and a specific heat of 4.18 J/(g ∙ °C),calculate the final temperature of the solution.
Ca2+(aq)+ 2 F-(aq)→ CaF2(s)ΔH° = -11.5 kJ
A)24.45°C
B)25.55°C
C)26.10°C
D)26.65°C
Ca2+(aq)+ 2 F-(aq)→ CaF2(s)ΔH° = -11.5 kJ
A)24.45°C
B)25.55°C
C)26.10°C
D)26.65°C

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
48
The values of ΔH°f for the three states of benzene are approximately -22 kcal/mol,-11 kcal/mol,and 20 kcal/mol.Which is the value for solid benzene?
A)-22 kcal/mol
B)-11 kcal/mol
C)20 kcal/mol
D)cannot be determined without additional information
A)-22 kcal/mol
B)-11 kcal/mol
C)20 kcal/mol
D)cannot be determined without additional information

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
49
Which equation represents the reaction whose ΔH,represents the standard enthalpy of formation of CHCl3(l)at 25°C? (i.e. ,for which is ΔH = ΔH°f of CHCl3)
A)CHCl3(l)→ C(s)+ H(g)+ 3 Cl(g)
B)C(s)+ H(g)+ 3 Cl(g)→ CHCl3(l)
C)C(s)+ 1/2 H2(g)+ 3/2 Cl2(g)→ CHCl3(l)
D)2 C(s)+ H2(g)+ 3 Cl2(g)→ 2 CHCl3(l)
A)CHCl3(l)→ C(s)+ H(g)+ 3 Cl(g)
B)C(s)+ H(g)+ 3 Cl(g)→ CHCl3(l)
C)C(s)+ 1/2 H2(g)+ 3/2 Cl2(g)→ CHCl3(l)
D)2 C(s)+ H2(g)+ 3 Cl2(g)→ 2 CHCl3(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
50
Find ΔH for BaCO3 (s)→ BaO (s)+ CO2 (g)
Given 2 Ba (s)+ O2 (g)→ 2 BaO (s)ΔH = -1107.0 kJ
Ba (s)+ CO2 (g)+ 1/2 O2 (g)→ BaCO3 (g)ΔH = -822.5 kJ
A)-1929.5 kJ
B)-1376.0 kJ
C)-284.5 kJ
D)269.0 kJ
Given 2 Ba (s)+ O2 (g)→ 2 BaO (s)ΔH = -1107.0 kJ
Ba (s)+ CO2 (g)+ 1/2 O2 (g)→ BaCO3 (g)ΔH = -822.5 kJ
A)-1929.5 kJ
B)-1376.0 kJ
C)-284.5 kJ
D)269.0 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
51
Find ΔH for C3H8 (g)+ 6 H2O (g)→ 3 CO2 (g)+ 10 H2
Given C3H8 (g)+ 3 H2O (g)→ 3 CO (g)+ 7 H2 (g)ΔH = 499 kJ
CO (g)+ H2O (g)→ CO2 (g)+ H2 (g)ΔH = -41 kJ
A)376 kJ
B)458 kJ
C)540 kJ
D)622 kJ
Given C3H8 (g)+ 3 H2O (g)→ 3 CO (g)+ 7 H2 (g)ΔH = 499 kJ
CO (g)+ H2O (g)→ CO2 (g)+ H2 (g)ΔH = -41 kJ
A)376 kJ
B)458 kJ
C)540 kJ
D)622 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
52
When 0.455 g of anthracene,C14H10,is combusted in a bomb calorimeter that has a water jacket containing 500.g of water,the temperature of the water increases by 8.63°C.Assuming that the specific heat of water is 4.18 J/(g ∙ °C),and that the heat absorption by the calorimeter is negligible,estimate the enthalpy of combustion per mole of anthracene.
A)+39.7 kJ/mol
B)-39.7 kJ/mol
C)-7070 kJ/mol
D)-8120 kJ/mol
A)+39.7 kJ/mol
B)-39.7 kJ/mol
C)-7070 kJ/mol
D)-8120 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
53
Find ΔH° for the reaction C3H8(g)+ 5 O2(g)→ 3 CO2(g)+ 4 H2O(l).
ΔH° = -2046 kJ for the reaction: C3H8(g)+ 5 O2(g)→ 3 CO2(g)+ 4 H2O(g),and the heat of vaporization of water is 44.0 kJ/mol.Note that H2O is a liquid in the first reaction and a gas in the second.
A)-2222 kJ
B)-2090 kJ
C)-2002 kJ
D)-1870 kJ
ΔH° = -2046 kJ for the reaction: C3H8(g)+ 5 O2(g)→ 3 CO2(g)+ 4 H2O(g),and the heat of vaporization of water is 44.0 kJ/mol.Note that H2O is a liquid in the first reaction and a gas in the second.
A)-2222 kJ
B)-2090 kJ
C)-2002 kJ
D)-1870 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
54
Water has an unusually high
A)electrical conductivity.
B)heat of combustion.
C)heat of formation.
D)specific heat.
A)electrical conductivity.
B)heat of combustion.
C)heat of formation.
D)specific heat.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
55
The specific heat of copper is 0.385 J/(g ∙°C).If 34.2 g of copper,initially at 25°C,absorbs 4.689 kJ,what will be the final temperature of the copper?
A)25.4°C
B)27.8°C
C)356°C
D)381°C
A)25.4°C
B)27.8°C
C)356°C
D)381°C

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
56
Use the given standard enthalpies of formation to calculate ΔH° for the following reaction
3 Fe2O3(s)+ CO(g)→ 2 Fe3O4(s)+ CO2(g).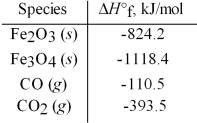
A)-5213.4 kJ
B)-577.2 kJ
C)-47.2 kJ
D)+47.2 kJ
3 Fe2O3(s)+ CO(g)→ 2 Fe3O4(s)+ CO2(g).

A)-5213.4 kJ
B)-577.2 kJ
C)-47.2 kJ
D)+47.2 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
57
10.0 g of a metal,initially at 25°C,are placed into 10.0 g of water,initially at 100°C.Which metal will have the highest final temperature? Shown after each metal is its specific heat in J/(g∙°C).
A)aluminum (0.902)
B)copper (0.385)
C)Gold (0.129)
D)iron (0.450)
A)aluminum (0.902)
B)copper (0.385)
C)Gold (0.129)
D)iron (0.450)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
58
Which is expected to have the lowest specific heat capacity at 25°C?
A)air
B)copper
C)polyethylene
D)water
A)air
B)copper
C)polyethylene
D)water

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
59
When 1.50 g of Ba(s)is added to 100.00 g of water in a container open to the atmosphere,the reaction shown below occurs and the temperature of the resulting solution rises from 22.00°C to 33.10°C.If the specific heat of the solution is 4.18 J/(g ∙°C),calculate ΔH for the reaction,as written.
Ba(s)+ 2 H2O(l)→ Ba(OH)2(aq)+ H2(g)ΔH = ?
A)-431 kJ
B)-3.14 kJ
C)3)14 kJ
D)431 kJ
Ba(s)+ 2 H2O(l)→ Ba(OH)2(aq)+ H2(g)ΔH = ?
A)-431 kJ
B)-3.14 kJ
C)3)14 kJ
D)431 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
60
For which should the standard heat of formation ΔH°f,be zero at 25°C?
A)O(g)
B)O2(g)
C)O3(g)
D)all the above
A)O(g)
B)O2(g)
C)O3(g)
D)all the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
61
The heat of combustion per mole for acetylene,C2H2(g),is -1299.5 kJ/mol.Assuming that the combustion products are CO2(g)and H2O(l),and given that the enthalpy of formation is -393.5 kJ/mol for CO2(g)and -285.8 kJ/mol for H2O(l),find the enthalpy of formation of C2H2(g).
A)-846.1 kJ/mol
B)-620.2 kJ/mol
C)-226.7 kJ/mol
D)+226.7 kJ/mol
A)-846.1 kJ/mol
B)-620.2 kJ/mol
C)-226.7 kJ/mol
D)+226.7 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
62
Which of the following is not true?
A)A spontaneous reaction need not occur immediately.
B)A spontaneous reaction must be exothermic and must have an increase in entropy.
C)The reverse of a nonspontaneous reaction is always spontaneous.
D)A spontaneous reaction is one that can proceed on its own.
A)A spontaneous reaction need not occur immediately.
B)A spontaneous reaction must be exothermic and must have an increase in entropy.
C)The reverse of a nonspontaneous reaction is always spontaneous.
D)A spontaneous reaction is one that can proceed on its own.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
63
Which is expected to have the largest carbon-oxygen bond dissociation energy?
A)CO
B)CO2
C)HCO2H
D)CO32-
A)CO
B)CO2
C)HCO2H
D)CO32-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
64
For the of freezing liquid ethanol at a given temperature and pressure,
A)ΔH is negative and ΔS is negative.
B)ΔH is negative and ΔS is positive.
C)ΔH is positive and ΔS is negative.
D)ΔH is positive and ΔS is positive.
A)ΔH is negative and ΔS is negative.
B)ΔH is negative and ΔS is positive.
C)ΔH is positive and ΔS is negative.
D)ΔH is positive and ΔS is positive.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
65
For which reaction is H expected to be most positive?
A)N2(g)→ 2 N(g)
B)O2(g)→ 2 O(g)
C)2 N(g)→ N2(g)
D)2 O(g)→ O2(g)
A)N2(g)→ 2 N(g)
B)O2(g)→ 2 O(g)
C)2 N(g)→ N2(g)
D)2 O(g)→ O2(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
66
Acetylene torches utilize the following reaction:
2 C2H2(g)+ 5 O2(g)→ 4 CO2(g)+ 2 H2O(g)
Use the given standard enthalpies of formation to calculate ΔH° for this reaction.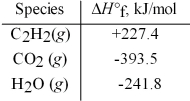
A)2512.4 kJ
B)1256.2 kJ
C)-1256.2 kJ
D)-2512.4 kJ
2 C2H2(g)+ 5 O2(g)→ 4 CO2(g)+ 2 H2O(g)
Use the given standard enthalpies of formation to calculate ΔH° for this reaction.

A)2512.4 kJ
B)1256.2 kJ
C)-1256.2 kJ
D)-2512.4 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
67
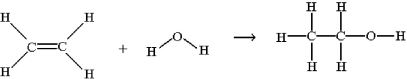
One method for making ethanol,C2H5OH,involves the gas-phase hydration of ethylene,C2H4:
Estimate ΔH for this reaction from the given average bond dissociation energies,D.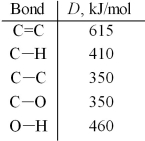
A)-580 kJ
B)-35 kJ
C)+35 kJ
D)580 kJ
Estimate ΔH for this reaction from the given average bond dissociation energies,D.


A)-580 kJ
B)-35 kJ
C)+35 kJ
D)580 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
68
Given that ΔH°= -311 kJ for the hydrogenation of acetylene,C2H2:
H-C=C-H(g)+ 2 H2(g)→ CH3-CH3(g)
And the following bond dissociation energies,estimate a value for the C-to-C triple bond dissociation energy.
A)1050 kJ/mol
B)833 kJ/mol
C)807 kJ/mol
D)397 kJ/mol
H-C=C-H(g)+ 2 H2(g)→ CH3-CH3(g)
And the following bond dissociation energies,estimate a value for the C-to-C triple bond dissociation energy.

A)1050 kJ/mol
B)833 kJ/mol
C)807 kJ/mol
D)397 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
69
Which of the following can be interpreted as a measure of randomness?
A)enthalpy
B)entropy
C)free energy
D)temperature
A)enthalpy
B)entropy
C)free energy
D)temperature

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
70
For the reaction 2CH4 (g)+ 3 Cl2 (g)→ 2 CHCl3 (l)+ 3 H2 (g),ΔH° = -118.6 kJ.
ΔH°f = -134.1 kJ/mol for CHCl3 (l).Find ΔH°f for CH4 (g).
A)-193.4 kJ/mol
B)-74.8 kJ/mol
C)74.8 kJ/mol
D)193.4 kJ/mol
ΔH°f = -134.1 kJ/mol for CHCl3 (l).Find ΔH°f for CH4 (g).
A)-193.4 kJ/mol
B)-74.8 kJ/mol
C)74.8 kJ/mol
D)193.4 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
71
Calculate the enthalpy of combustion per mole for C6H12O6.Assume that the combustion products are CO2(g)and H2O(l). 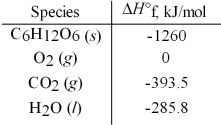
A)-5336 kJ/mol
B)-2816 kJ/mol
C)-1939 kJ/mol
D)580.7 kJ/mol

A)-5336 kJ/mol
B)-2816 kJ/mol
C)-1939 kJ/mol
D)580.7 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
72
For the expansion of an ideal gas into a vacuum at constant temperature,ΔH = 0.What can be said about ΔE and ΔS?
A)ΔE is negative and ΔS is positive.
B)ΔE is zero and ΔS is positive.
C)ΔE is negative and ΔS is zero.
D)ΔE is positive and ΔS is negative.
A)ΔE is negative and ΔS is positive.
B)ΔE is zero and ΔS is positive.
C)ΔE is negative and ΔS is zero.
D)ΔE is positive and ΔS is negative.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
73
Determine the sign of ΔS° for each of the following:
I.C6H6(s)→ C6H6(l)
II.2 SO2(g)+ O2(g)→ 2 SO3(g)
A)ΔS° should be negative for I and negative for II.
B)ΔS° should be negative for I and positive for II.
C)ΔS° should be positive for I and negative for II.
D)ΔS° should be positive for I and positive for II.
I.C6H6(s)→ C6H6(l)
II.2 SO2(g)+ O2(g)→ 2 SO3(g)
A)ΔS° should be negative for I and negative for II.
B)ΔS° should be negative for I and positive for II.
C)ΔS° should be positive for I and negative for II.
D)ΔS° should be positive for I and positive for II.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
74
Which thermodynamic function is most related to disorder and probability?
A)enthalpy
B)internal energy
C)entropy
D)heat capacity
A)enthalpy
B)internal energy
C)entropy
D)heat capacity

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
75
For the reaction,NH3(g)→ N(g)+ 3 H(g),one would expect
A)ΔH° to be negative and ΔS° to be negative.
B)ΔH° to be negative and ΔS° to be positive.
C)ΔH° to be positive and ΔS° to be negative.
D)ΔH° to be positive and ΔS° to be positive.
A)ΔH° to be negative and ΔS° to be negative.
B)ΔH° to be negative and ΔS° to be positive.
C)ΔH° to be positive and ΔS° to be negative.
D)ΔH° to be positive and ΔS° to be positive.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
76
Which of CH4(g),C2H2(g),and CH3OH(l)provides the most energy per gram upon combustion and which provides the least?
CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(l)ΔH° = -890 kJ
2 C2H2(g)+ 5 O2(g)→ 4 CO2(g)+ 2 H2O(l)ΔH° = -2599 kJ
2 CH3OH(l)+ 3 O2(g)→ 2 CO2(g)+ 4 H2O(l)ΔH° = -1453 kJ
A)C2H2 provides the most energy per gram and CH4 the least.
B)C2H2 provides the most energy per gram and CH3OH the least.
C)CH4 provides the most energy per gram and CH3OH the least.
D)CH4 provides the most energy per gram and C2H2 the least.
CH4(g)+ 2 O2(g)→ CO2(g)+ 2 H2O(l)ΔH° = -890 kJ
2 C2H2(g)+ 5 O2(g)→ 4 CO2(g)+ 2 H2O(l)ΔH° = -2599 kJ
2 CH3OH(l)+ 3 O2(g)→ 2 CO2(g)+ 4 H2O(l)ΔH° = -1453 kJ
A)C2H2 provides the most energy per gram and CH4 the least.
B)C2H2 provides the most energy per gram and CH3OH the least.
C)CH4 provides the most energy per gram and CH3OH the least.
D)CH4 provides the most energy per gram and C2H2 the least.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
77
Determine the sign of ΔS° for each of the following:
I.The mixing of two gases at a given temperature and pressure
II.C(s)+ 2 H2O(g)→ CO2(g)+ 2 H2(g)
A)ΔS° is negative for I and negative for II.
B)ΔS° is negative for I and positive for II.
C)ΔS° is positive for I and negative for II.
D)ΔS° is positive for I and positive for II.
I.The mixing of two gases at a given temperature and pressure
II.C(s)+ 2 H2O(g)→ CO2(g)+ 2 H2(g)
A)ΔS° is negative for I and negative for II.
B)ΔS° is negative for I and positive for II.
C)ΔS° is positive for I and negative for II.
D)ΔS° is positive for I and positive for II.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
78
Use the given average bond dissociation energies,D,to estimate ΔH for the reaction of methane,CH4(g),with fluorine according to the equation:
CH4(g)+ 2 F2(g)→ CF4(g)+ 2 H2(g)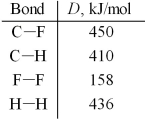
A)-716 kJ
B)-318 kJ
C)+318 kJ
D)+716 kJ
CH4(g)+ 2 F2(g)→ CF4(g)+ 2 H2(g)

A)-716 kJ
B)-318 kJ
C)+318 kJ
D)+716 kJ

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
79
At a given temperature and pressure,which of the following would be expected to have the greatest molar entropy?
A)Br2(s)
B)Br2(l)
C)Br2(g)
D)All of these would be expected to have the same molar entropy.
A)Br2(s)
B)Br2(l)
C)Br2(g)
D)All of these would be expected to have the same molar entropy.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
80
Ethyl alcohol is produced by the fermentation of glucose,C6H12O6.
C6H12O6(s)→ 2 C2H5OH(l)+ 2 CO2(g)ΔH° = -69.1 kJ
Given that the enthalpy of formation is -277.7 kJ/mol for C2H5OH(l)and -393.5 kJ/mol for CO2(g),find the enthalpy of formation for C6H12O6.
A)-1411.5 kJ/mol
B)-1273.3 kJ/mol
C)-740.3 kJ/mol
D)-602.1 kJ/mol
C6H12O6(s)→ 2 C2H5OH(l)+ 2 CO2(g)ΔH° = -69.1 kJ
Given that the enthalpy of formation is -277.7 kJ/mol for C2H5OH(l)and -393.5 kJ/mol for CO2(g),find the enthalpy of formation for C6H12O6.
A)-1411.5 kJ/mol
B)-1273.3 kJ/mol
C)-740.3 kJ/mol
D)-602.1 kJ/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck








