Deck 15: Acids and Bases
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/163
العب
ملء الشاشة (f)
Deck 15: Acids and Bases
1
Identify the conjugate base of HCO3- in the reaction CO32- + HSO4-  HCO3- + SO42-
HCO3- + SO42-
A)HSO4-
B)CO32-
C)OH-
D)H3O+
E)SO42-
 HCO3- + SO42-
HCO3- + SO42-A)HSO4-
B)CO32-
C)OH-
D)H3O+
E)SO42-
CO32-
2
Identify the conjugate acid of HCO3- in the reaction HCO3- + HPO42-  H2CO3 + PO43-
H2CO3 + PO43-
A)H2O
B)HCO3-
C)H2CO3
D)PO43-
E)HPO42-
 H2CO3 + PO43-
H2CO3 + PO43-A)H2O
B)HCO3-
C)H2CO3
D)PO43-
E)HPO42-
H2CO3
3
Identify the conjugate acid of SO42- in the reaction CO32- + HSO4-  HCO3- + SO42-
HCO3- + SO42-
A)CO32-
B)HSO4-
C)OH-
D)H3O+
E)SO42-
 HCO3- + SO42-
HCO3- + SO42-A)CO32-
B)HSO4-
C)OH-
D)H3O+
E)SO42-
HSO4-
4
The OH- concentration in a 1.0 * 10-3 M Ba(OH)2 solution is
A)0.50 * 10-3 M.
B)1.0 * 10-3 M.
C)2.0 * 10-3 M.
D)1.0 * 10-2 M.
E)0.020 M.
A)0.50 * 10-3 M.
B)1.0 * 10-3 M.
C)2.0 * 10-3 M.
D)1.0 * 10-2 M.
E)0.020 M.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
5
What is the H+ ion concentration in a 4.8 * 10-2 M KOH solution?
A)4.8 * 10-2 M
B)1.0 * 10-7 M
C)4.8 * 10-11 M
D)4.8 * 10-12 M
E)2.1 * 10-13 M
A)4.8 * 10-2 M
B)1.0 * 10-7 M
C)4.8 * 10-11 M
D)4.8 * 10-12 M
E)2.1 * 10-13 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
6
In the reaction HSO4-(aq)+ OH-(aq)  SO42-(aq)+ H2O(l), the conjugate acid-base pairs are
SO42-(aq)+ H2O(l), the conjugate acid-base pairs are 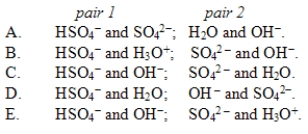
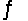 SO42-(aq)+ H2O(l), the conjugate acid-base pairs are
SO42-(aq)+ H2O(l), the conjugate acid-base pairs are 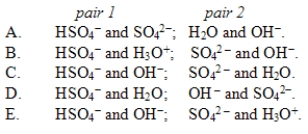

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
7
Which one of these statements about strong acids is true?
A)All strong acids have H atoms bonded to electronegative oxygen atoms.
B)Strong acids are 100% ionized in water.
C)The conjugate base of a strong acid is itself a strong base.
D)Strong acids are very concentrated acids.
E)Strong acids produce solutions with a higher pH than weak acids.
A)All strong acids have H atoms bonded to electronegative oxygen atoms.
B)Strong acids are 100% ionized in water.
C)The conjugate base of a strong acid is itself a strong base.
D)Strong acids are very concentrated acids.
E)Strong acids produce solutions with a higher pH than weak acids.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
8
What is the pH of an aqueous solution that contains 2.7 *1020 H3O+ ions per liter of solution?
A)2.70
B)3.35
C)6.02
D)10.65
E)11.30
A)2.70
B)3.35
C)6.02
D)10.65
E)11.30

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
9
Identify the conjugate base of HSO4 - in the reaction H2PO4- + HSO4- 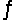 H3PO4 + SO42-
H3PO4 + SO42-
A)H2PO4-
B)H2SO4
C)H2O
D)H3PO4
E)SO42-
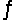 H3PO4 + SO42-
H3PO4 + SO42-A)H2PO4-
B)H2SO4
C)H2O
D)H3PO4
E)SO42-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
10
Identify the conjugate base of HPO42- in the reaction HCO3- + HPO42-  H2CO3 + PO43-
H2CO3 + PO43-
A)H2O
B)HCO3-
C)H2CO3
D)PO43-
E)None of these.
 H2CO3 + PO43-
H2CO3 + PO43-A)H2O
B)HCO3-
C)H2CO3
D)PO43-
E)None of these.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
11
What is the concentration of H+ in a 2.5 M HCl solution?
A)0
B)1.3 M
C)2.5 M
D)5.0 M
E)10.M
A)0
B)1.3 M
C)2.5 M
D)5.0 M
E)10.M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
12
Which is not a characteristic property of acids?
A)neutralizes bases
B)turns litmus from blue to red
C)reacts with active metals to produce H2(g)
D)reacts with CO2(g)to form carbonates
E)All of the above are characteristic properties of acids.
A)neutralizes bases
B)turns litmus from blue to red
C)reacts with active metals to produce H2(g)
D)reacts with CO2(g)to form carbonates
E)All of the above are characteristic properties of acids.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
13
In the reaction H2CO3 + H2O  HCO3- + H3O+, the Brønsted acids are
HCO3- + H3O+, the Brønsted acids are
A)H2CO3 and H2O.
B)HCO3- and H2CO3.
C)H2O and H3O+.
D)H3O+ and H2CO3.
E)H2O and HCO3-.
 HCO3- + H3O+, the Brønsted acids are
HCO3- + H3O+, the Brønsted acids areA)H2CO3 and H2O.
B)HCO3- and H2CO3.
C)H2O and H3O+.
D)H3O+ and H2CO3.
E)H2O and HCO3-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
14
Identify the conjugate acid of CO32- in the reaction CO32- + H2PO4-  HCO3- + HPO42-
HCO3- + HPO42-
A)H2CO3
B)HCO3-
C)H2O
D)HPO42-
E)H2PO4-
 HCO3- + HPO42-
HCO3- + HPO42-A)H2CO3
B)HCO3-
C)H2O
D)HPO42-
E)H2PO4-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
15
Identify the conjugate base of HClO3 in the reaction ClO3- + HSO4-  HClO3 + SO42-
HClO3 + SO42-
A)ClO3-
B)HSO4-
C)OH-
D)H3O+
E)SO42-
 HClO3 + SO42-
HClO3 + SO42-A)ClO3-
B)HSO4-
C)OH-
D)H3O+
E)SO42-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
16
Which is the formula for the hydronium ion?
A)OH-
B)H2O
C)H3O+
D)H3O-
E)H2O+
A)OH-
B)H2O
C)H3O+
D)H3O-
E)H2O+

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
17
The OH- concentration in a 2.5 * 10-3 M Ba(OH)2 solution is
A)4.0 * 10-12 M.
B)2.5 * 10-3 M.
C)5.0 * 10-3 M.
D)1.2 * 10-2 M.
E)0.025 M.
A)4.0 * 10-12 M.
B)2.5 * 10-3 M.
C)5.0 * 10-3 M.
D)1.2 * 10-2 M.
E)0.025 M.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
18
Identify the conjugate base of CH3COOH in the reaction CH3COOH + HSO4-  H2SO4 + CH3COO-
H2SO4 + CH3COO-
A)HSO4-
B)SO42-
C)CH3COO-
D)H2SO4
E)OH-
 H2SO4 + CH3COO-
H2SO4 + CH3COO-A)HSO4-
B)SO42-
C)CH3COO-
D)H2SO4
E)OH-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
19
What is the pH of an aqueous solution that contains 5.3 *1017 OH- ions per liter of solution?
A)5.30
B)6.06
C)7.94
D)8.70
E)11.3
A)5.30
B)6.06
C)7.94
D)8.70
E)11.3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
20
The OH- concentration in a 7.5 * 10-3 M Ca(OH)2 solution is
A)7.5 * 10-3 M.
B)1.5 * 10-2 M.
C)1.3 * 10-12 M.
D)1.0 * 10-7 M.
E)1.0 * 10-14 M.
A)7.5 * 10-3 M.
B)1.5 * 10-2 M.
C)1.3 * 10-12 M.
D)1.0 * 10-7 M.
E)1.0 * 10-14 M.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
21
Calculate the H+ ion concentration in a 8.8 * 10-4 M Ca(OH)2 solution.
A)8.8 * 10-4 M
B)1.8 * 10-3 M
C)2.2 * 10-11 M
D)1.1 * 10-11 M
E)5.7 * 10-12 M
A)8.8 * 10-4 M
B)1.8 * 10-3 M
C)2.2 * 10-11 M
D)1.1 * 10-11 M
E)5.7 * 10-12 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
22
A 0.10 M HF solution is 8.4% ionized. Calculate the H+ ion concentration.
A)0.84 M
B)0.12 M
C)0.10 M
D)0.084 M
E)8.4 * 10-3 M
A)0.84 M
B)0.12 M
C)0.10 M
D)0.084 M
E)8.4 * 10-3 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
23
Calculate the pH of a 6.71 * 10-2 M NaOH solution.
A)12.83
B)2.17
C)11.82
D)6.71
E)1.17
A)12.83
B)2.17
C)11.82
D)6.71
E)1.17

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
24
Calculate the H+ ion concentration in lemon juice having a pH of 2.4.
A)4.0 * 10-2 M
B)250 M
C)0.38 M
D)4.0 * 10-3 M
E)12 M
A)4.0 * 10-2 M
B)250 M
C)0.38 M
D)4.0 * 10-3 M
E)12 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
25
Calculate the pH of a carbonated beverage in which the hydrogen ion concentration is 3.4 * 10-4 M.
A)2.34
B)3.47
C)6.01
D)7.99
E)10.53
A)2.34
B)3.47
C)6.01
D)7.99
E)10.53

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
26
Determine the pH of a KOH solution made by mixing 0.251 g KOH with enough water to make 1.00 * 102 mL of solution.
A)1.35
B)2.35
C)7.00
D)11.65
E)12.65
A)1.35
B)2.35
C)7.00
D)11.65
E)12.65

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
27
What is the OH- ion concentration in a 5.2 * 10-4 M HNO3 solution?
A)1.9 * 10-11 M
B)1.0 * 10-7 M
C)5.2 * 10-4 M
D)zero
E)1.0 * 10-4 M
A)1.9 * 10-11 M
B)1.0 * 10-7 M
C)5.2 * 10-4 M
D)zero
E)1.0 * 10-4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
28
Calculate the pH of 2.6 * 10-2 M KOH.
A)12.41
B)15.59
C)2.06
D)7.00
E)1.59
A)12.41
B)15.59
C)2.06
D)7.00
E)1.59

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
29
A 0.14 M HNO2 solution is 5.7% ionized. Calculate the H+ ion concentration.
A)8.0 * 10-3 M
B)0.057 M
C)0.13 M
D)0.14 M
E)0.80 M
A)8.0 * 10-3 M
B)0.057 M
C)0.13 M
D)0.14 M
E)0.80 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
30
Calculate the pH of a 0.10 M HCN solution that is 0.0070% ionized.
A)1.00
B)0.00070
C)3.15
D)5.15
E)7.00
A)1.00
B)0.00070
C)3.15
D)5.15
E)7.00

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
31
What is the pH of a 0.001 M Ca(OH)2 solution?
A)3.0
B)11.0
C)2.7
D)17.0
E)11.3
A)3.0
B)11.0
C)2.7
D)17.0
E)11.3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
32
A 0.10 M NH3 solution is 1.3% ionized. Calculate the H+ ion concentration. NH3 + H2O  NH4+ + OH-
NH4+ + OH-
A)1.3 * 10-3 M
B)7.7 * 10-2 M
C)7.7 * 10-12 M
D)0.13 M
E)0.10 M
 NH4+ + OH-
NH4+ + OH-A)1.3 * 10-3 M
B)7.7 * 10-2 M
C)7.7 * 10-12 M
D)0.13 M
E)0.10 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
33
What is the pH of 10.0 mL of 0.0020 M HCl?
A)0.70
B)2.70
C)3.70
D)5.70
E)10.0
A)0.70
B)2.70
C)3.70
D)5.70
E)10.0

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
34
Calculate the hydrogen ion concentration in a solution of fruit juice having a pH of 4.25.
A)1.0 * 10-14 M
B)5.6 * 10-5 M
C)4.0 * 10-25 M
D)2.5 * 10-4 M
E)5.6 * 10-4 M
A)1.0 * 10-14 M
B)5.6 * 10-5 M
C)4.0 * 10-25 M
D)2.5 * 10-4 M
E)5.6 * 10-4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
35
What is the pH of a 0.014 M Ca(OH)2 solution?
A)1.85
B)1.55
C)12.15
D)12.45
E)15.85
A)1.85
B)1.55
C)12.15
D)12.45
E)15.85

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
36
Calculate the pH of a 1.6 M KOH solution.
A)1.60
B)-0.20
C)0.20
D)14.20
E)13.80
A)1.60
B)-0.20
C)0.20
D)14.20
E)13.80

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
37
Calculate the pH of a 0.14 M HNO2 solution that is 5.7% ionized.
A)0.85
B)1.70
C)2.10
D)11.90
E)13.10
A)0.85
B)1.70
C)2.10
D)11.90
E)13.10

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
38
Calculate the pH of a 3.5 * 10-3 M HNO3 solution.
A)-2.46
B)0.54
C)2.46
D)3.00
E)3.46
A)-2.46
B)0.54
C)2.46
D)3.00
E)3.46

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
39
Consider the weak acid CH3COOH (acetic acid). If a 0.048 M CH3COOH solution is 5.2% ionized, determine the [H3O+] concentration at equilibrium.
A)0.25 M
B)9.2 * 10-3 M
C)0.048 M
D)0.052 M
E)2.5 * 10-3 M
A)0.25 M
B)9.2 * 10-3 M
C)0.048 M
D)0.052 M
E)2.5 * 10-3 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
40
What is the pH of a 0.0055 M HA (weak acid)solution that is 8.2% ionized?
A)2.26
B)3.35
C)4.52
D)8.21
E)10.65
A)2.26
B)3.35
C)4.52
D)8.21
E)10.65

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
41
The pH of tomato juice is about 4.5. Calculate the concentration of hydrogen ions in this juice.
A)3.* 10-10 M
B)3.* 10-5 M
C)5.* 10-4 M
D)4.M
E)3.* 1010 M
A)3.* 10-10 M
B)3.* 10-5 M
C)5.* 10-4 M
D)4.M
E)3.* 1010 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
42
The pH of a certain solution is 3.0. How many H+(aq)ions are there in 1.0 L of the solution?
A)0.001 ions
B)1,000 ions
C)6.* 1020 ions
D)3 ions
E)6.* 1026 ions
A)0.001 ions
B)1,000 ions
C)6.* 1020 ions
D)3 ions
E)6.* 1026 ions

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
43
Acid strength decreases in the series: HNO3 > HF > CH3COOH. Which of these species is the strongest base?
A)NO3-
B)CH3COO-
C)F-
D)CH3COOH
A)NO3-
B)CH3COO-
C)F-
D)CH3COOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
44
What is the pH of a solution prepared by mixing 10.0 mL of a strong acid solution with pH = 2.00 and 10.0 mL of a strong acid solution with pH = 6.00?
A)2.0
B)2.3
C)4.0
D)6.0
E)8.0
A)2.0
B)2.3
C)4.0
D)6.0
E)8.0

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
45
Acid strength decreases in the series: strongest HSO4- > HF > HCN. Which of these species is the weakest base?
A)HF
B)SO42-
C)F-
D)CN-
A)HF
B)SO42-
C)F-
D)CN-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
46
The pOH of a solution is 9.60.Calculate the hydrogen ion concentration in this solution.
A)2.5 * 10-10 M
B)6.0 * 10-9 M
C)4.0 * 10-5 M
D)2.4 * 10-4 M
E)1.0 * 10-14 M
A)2.5 * 10-10 M
B)6.0 * 10-9 M
C)4.0 * 10-5 M
D)2.4 * 10-4 M
E)1.0 * 10-14 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
47
Calculate the hydrogen ion concentration in a solution having a pH of 4.60.
A)4.0 * 10-3 M
B)4.0 * 10-9 M
C)4.0 * 10-10 M
D)2.5 * 10-5 M
E)2.5 * 10-4 M
A)4.0 * 10-3 M
B)4.0 * 10-9 M
C)4.0 * 10-10 M
D)2.5 * 10-5 M
E)2.5 * 10-4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
48
Acid strength decreases in the series: HCl > HSO4- > HCN. Which of these species is the strongest base?
A)CN-
B)SO42-
C)HCN
D)Cl-
A)CN-
B)SO42-
C)HCN
D)Cl-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
49
Diet cola drinks have a pH of about 3.0, while milk has a pH of about 7.0. How many times greater is the H3O+ concentration in diet cola than in milk?
A)2.3 times higher in diet cola than in milk
B)400 times higher in diet cola than in milk
C)0.43 times higher in diet cola than in milk
D)1,000 times higher in diet cola than in milk
E)10,000 times higher in diet cola than in milk
A)2.3 times higher in diet cola than in milk
B)400 times higher in diet cola than in milk
C)0.43 times higher in diet cola than in milk
D)1,000 times higher in diet cola than in milk
E)10,000 times higher in diet cola than in milk

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
50
The pH of coffee is approximately 5.0. How many times greater is the [H+] in coffee than in neutral water?
A)200
B)100
C)5.0
D)1.4
E)0.01
A)200
B)100
C)5.0
D)1.4
E)0.01

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
51
The pOH of a solution is 10.40.Calculate the hydrogen ion concentration in the solution.
A)4.0 * 10-11 M
B)3.6 M
C)4.0 * 10-10 M
D)2.5 * 10-4 M
E)1.8 * 10-4 M
A)4.0 * 10-11 M
B)3.6 M
C)4.0 * 10-10 M
D)2.5 * 10-4 M
E)1.8 * 10-4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
52
Which one of the following statements is true for a 0.1 M solution of a weak acid HA?
A)The concentration of H+ is slightly greater than the concentration of A-.
B)The pH equals 1.0.
C)The concentration of H+ is exactly equal to the concentration of A-.
D)The pH is less than 1.0.
E)The concentration of H+ is slightly less than the concentration of A-.
A)The concentration of H+ is slightly greater than the concentration of A-.
B)The pH equals 1.0.
C)The concentration of H+ is exactly equal to the concentration of A-.
D)The pH is less than 1.0.
E)The concentration of H+ is slightly less than the concentration of A-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
53
Acid strength increases in the series: HCN < HF < HSO4-. Which of these species is the strongest base?
A)H2SO4
B)SO42-
C)F-
D)CN -
E)HSO4-
A)H2SO4
B)SO42-
C)F-
D)CN -
E)HSO4-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
54
If the pH of an acid rain storm is approximately 3.0, how many times greater is the [H+] in the rain than in a cup of coffee having a pH of 5.0?
A)1000
B)100
C)20
D)1.7
E)0.60
A)1000
B)100
C)20
D)1.7
E)0.60

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
55
Calculate the hydrogen ion concentration in a solution of iced tea with lemon having a pH of 2.87.
A)2.9 * 10-2 M
B)5.7 * 10-2 M
C)1.3 * 10-3 M
D)2.9 * 10-3 M
E)5.7 * 10-4 M
A)2.9 * 10-2 M
B)5.7 * 10-2 M
C)1.3 * 10-3 M
D)2.9 * 10-3 M
E)5.7 * 10-4 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
56
The pH of coffee is approximately 5.0. How many times greater is the [H3O+] in coffee than in tap water having a pH of 8.0?
A)0.62
B)1.6
C)30
D)1,000
E)1.0 * 104
A)0.62
B)1.6
C)30
D)1,000
E)1.0 * 104

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
57
The pH of a Ba(OH)2 solution is 10.00. What is the H+ ion concentration of this solution?
A)4.0 * 10-11 M
B)1.6 * 10-10 M
C)1.3 * 10-5 M
D)1.0 * 10-10 M
E)10.M
A)4.0 * 10-11 M
B)1.6 * 10-10 M
C)1.3 * 10-5 M
D)1.0 * 10-10 M
E)10.M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
58
Which solution will have the lowest pH?
A)0.10 M HCN
B)0.10 M HNO3
C)0.10 M NaCl
D)0.10 M H2CO3
E)0.10 M NaOH
A)0.10 M HCN
B)0.10 M HNO3
C)0.10 M NaCl
D)0.10 M H2CO3
E)0.10 M NaOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
59
Acid strength decreases in the series HI > HSO4- > HF > HCN. Which of these anions is the weakest base?
A)I-
B)SO42-
C)F-
D)CN-
A)I-
B)SO42-
C)F-
D)CN-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
60
The pH of a certain solution is 2.0. How many H+(aq)ions are there in 1.0 L of the solution?
A)0.01 ions
B)100 ions
C)2 ions
D)6.* 1021 ions
E)6.* 1023 ions
A)0.01 ions
B)100 ions
C)2 ions
D)6.* 1021 ions
E)6.* 1023 ions

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
61
Which of the following yields a basic solution when dissolved in water?
A)NO2
B)P4O10
C)K2O
D)NaCl
E)SO2
A)NO2
B)P4O10
C)K2O
D)NaCl
E)SO2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
62
Hard water deposits (calcium carbonate)have built up around your bathroom sink. Which one of these substances would be most effective in dissolving the deposits?
A)ammonia
B)bleach (sodium hypochlorite)
C)lye (sodium hydroxide)
D)vinegar (acetic acid)
A)ammonia
B)bleach (sodium hypochlorite)
C)lye (sodium hydroxide)
D)vinegar (acetic acid)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
63
Predict the direction in which the equilibrium will lie for the reaction C6H5COO- + HF  C6H5COOH + F- .
C6H5COOH + F- .
Ka(C6H5COOH)= 6.5 *10-5; Ka(HF)= 7.1 *10-4
A)to the right
B)to the left
C)in the middle
 C6H5COOH + F- .
C6H5COOH + F- .Ka(C6H5COOH)= 6.5 *10-5; Ka(HF)= 7.1 *10-4
A)to the right
B)to the left
C)in the middle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
64
Which one of these equations represents the reaction of a weak acid with a strong base?
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
65
Predict the direction in which the equilibrium will lie for the reaction H3PO4(aq)+ HSO4-(aq)  H2PO4-(aq) + H2SO4(aq).
H2PO4-(aq) + H2SO4(aq).
Ka1(H3PO4)= 7.5 * 10-3; Ka(H2SO4)= very large
A)to the right
B)to the left
C)in the middle
 H2PO4-(aq) + H2SO4(aq).
H2PO4-(aq) + H2SO4(aq).Ka1(H3PO4)= 7.5 * 10-3; Ka(H2SO4)= very large
A)to the right
B)to the left
C)in the middle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
66
Predict the direction in which the equilibrium will lie for the reaction H3PO4 + NO3-  H2PO4- + HNO3 Ka(H3PO4)= 7.5 * 10-3
H2PO4- + HNO3 Ka(H3PO4)= 7.5 * 10-3
A)to the right
B)to the left
C)in the middle
 H2PO4- + HNO3 Ka(H3PO4)= 7.5 * 10-3
H2PO4- + HNO3 Ka(H3PO4)= 7.5 * 10-3A)to the right
B)to the left
C)in the middle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
67
Which one of these net ionic equations represents the reaction of a strong acid with a strong base?
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
68
P4O10 is classified as an acidic oxide because it
A)reacts with acids to produce a salt.
B)is insoluble in water.
C)reacts with water to produce OH-.
D)gives a solution of phosphoric acid, H3PO4, on dissolving in water.
E)can act as a Lewis base by donating electron pairs.
A)reacts with acids to produce a salt.
B)is insoluble in water.
C)reacts with water to produce OH-.
D)gives a solution of phosphoric acid, H3PO4, on dissolving in water.
E)can act as a Lewis base by donating electron pairs.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
69
Which one of these equations represents the reaction of a weak acid with a weak base?
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+(aq)+ CN-(aq)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
70
Arrange the acids H2Se, H2Te, and H2S in order of increasing acid strength.
A)H2S < H2Se < H2Te
B)H2S < H2Te < H2Se
C)H2Te < H2S < H2Se
D)H2Se < H2S < H2Te
E)H2Se < H2Te < H2S
A)H2S < H2Se < H2Te
B)H2S < H2Te < H2Se
C)H2Te < H2S < H2Se
D)H2Se < H2S < H2Te
E)H2Se < H2Te < H2S

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
71
Which one of these net ionic equations represents the reaction of a strong acid with a weak base?
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+ (aq)+ CN-(aq)
A)H+(aq)+ OH-(aq) H2O(aq)
B)H+(aq)+ CH3NH2(aq) CH3NH3+(aq)
C)OH-(aq)+ HCN(aq) H2O(aq)+ CN-(aq)
D)HCN(aq)+ CH3NH2(aq) CH3NH3+ (aq)+ CN-(aq)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
72
Arrange the acids HBr, H2Se, and H3As in order of increasing acid strength.
A)HBr < H2Se < H3As
B)HBr < H3As < H2Se
C)H2Se < H3As < HBr
D)H3As < H2Se < HBr
E)H3As < HBr < H2Se
A)HBr < H2Se < H3As
B)HBr < H3As < H2Se
C)H2Se < H3As < HBr
D)H3As < H2Se < HBr
E)H3As < HBr < H2Se

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
73
Which of the following yields an acidic solution when dissolved in water?
A)NO2
B)LiOH
C)K2O
D)NaCl
E)Ca(OH)2
A)NO2
B)LiOH
C)K2O
D)NaCl
E)Ca(OH)2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
74
Arrange the acids HOBr, HBrO3, and HBrO2 in order of increasing acid strength.
A)HOBr < HBrO3 < HBrO2
B)HOBr < HBrO2 < HBrO3
C)HBrO2 < HOBr < HBrO3
D)HBrO3 < HOBr < HBrO2
E)HBrO3 < HBrO2 < HOBr
A)HOBr < HBrO3 < HBrO2
B)HOBr < HBrO2 < HBrO3
C)HBrO2 < HOBr < HBrO3
D)HBrO3 < HOBr < HBrO2
E)HBrO3 < HBrO2 < HOBr

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
75
In the reaction CaO(s)+ SO2(g)  CaSO3(s),
CaSO3(s),
A)O2- acts as a Lewis base, and SO2 acts as a Lewis acid.
B)Ca2+ acts as a Lewis base, and SO42- acts as a Lewis acid.
C)SO42- acts as a Lewis base, and SO2 acts as a Lewis acid.
D)SO2 acts as a Lewis base, and O2- acts as a Lewis acid.
E)SO2 acts as a Lewis base, and Ca2+ acts as a Lewis acid.
 CaSO3(s),
CaSO3(s),A)O2- acts as a Lewis base, and SO2 acts as a Lewis acid.
B)Ca2+ acts as a Lewis base, and SO42- acts as a Lewis acid.
C)SO42- acts as a Lewis base, and SO2 acts as a Lewis acid.
D)SO2 acts as a Lewis base, and O2- acts as a Lewis acid.
E)SO2 acts as a Lewis base, and Ca2+ acts as a Lewis acid.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
76
Predict the direction in which the equilibrium will lie for the reaction H2SO3(aq)+ HCO3- (aq)  HSO3-(aq)+ H2CO3(aq).
HSO3-(aq)+ H2CO3(aq).
Ka1(H2SO3)= 1 * 10-2; Ka1(H2CO3)= 4.2 * 10-7
A)to the right
B)to the left
C)in the middle
 HSO3-(aq)+ H2CO3(aq).
HSO3-(aq)+ H2CO3(aq).Ka1(H2SO3)= 1 * 10-2; Ka1(H2CO3)= 4.2 * 10-7
A)to the right
B)to the left
C)in the middle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
77
Arrange the acids HOCl, HClO3, and HClO2 in order of increasing acid strength.
A)HOCl < HClO3 < HClO2
B)HOCl < HClO2 < HClO3
C)HClO2 < HOCl < HClO3
D)HClO3 < HOCl < HClO2
E)HClO3 < HClO2 < HOCl
A)HOCl < HClO3 < HClO2
B)HOCl < HClO2 < HClO3
C)HClO2 < HOCl < HClO3
D)HClO3 < HOCl < HClO2
E)HClO3 < HClO2 < HOCl

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
78
When comparing acid strength of binary acids HX, as X varies within a particular group of the periodic table, which one of these factors dominates in affecting the acid strength?
A)bond strength
B)electron withdrawing effects
C)percent ionic character of the H-X bond
D)solubility
E)Le Châtelier's principle
A)bond strength
B)electron withdrawing effects
C)percent ionic character of the H-X bond
D)solubility
E)Le Châtelier's principle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
79
Which of these acids is the strongest?
A)H2SO3
B)H2SeO3
C)H2TeO3
A)H2SO3
B)H2SeO3
C)H2TeO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck
80
Predict the direction in which the equilibrium will lie for the reaction H2CO3 + F-
 HCO3- + HF. Ka1( H2CO3)= 4.2 * 10-7; Ka(HF)= 7.1 * 10-4
HCO3- + HF. Ka1( H2CO3)= 4.2 * 10-7; Ka(HF)= 7.1 * 10-4
A)to the right
B)to the left
C)in the middle
 HCO3- + HF. Ka1( H2CO3)= 4.2 * 10-7; Ka(HF)= 7.1 * 10-4
HCO3- + HF. Ka1( H2CO3)= 4.2 * 10-7; Ka(HF)= 7.1 * 10-4A)to the right
B)to the left
C)in the middle

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 163 في هذه المجموعة.
فتح الحزمة
k this deck








