Deck 5: Classification and Balancing of Chemical Reactions
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/53
العب
ملء الشاشة (f)
Deck 5: Classification and Balancing of Chemical Reactions
1
Consider the balanced equation shown and identify the statement that is not true.
Na2SO4 (aq)+ BaCl2 (aq)→ 2 NaCl (aq)+ BaSO4 (s)
A)The coefficient of sodium sulfate is one.
B)Barium sulfate is produced in solid form.
C)Barium chloride is dissolved in water.
D)The products are barium sulfate and sodium chloride.
E)2 NaCl (aq)could also be correctly written as Na2Cl2 (aq).
Na2SO4 (aq)+ BaCl2 (aq)→ 2 NaCl (aq)+ BaSO4 (s)
A)The coefficient of sodium sulfate is one.
B)Barium sulfate is produced in solid form.
C)Barium chloride is dissolved in water.
D)The products are barium sulfate and sodium chloride.
E)2 NaCl (aq)could also be correctly written as Na2Cl2 (aq).
2 NaCl (aq)could also be correctly written as Na2Cl2 (aq).
2
When the following reaction is balanced the coefficient in front of carbon dioxide is:
____ C5H12 + ____ O2 → ____ CO2 + ____ H2O
A)5
B)6
C)12
D)10
____ C5H12 + ____ O2 → ____ CO2 + ____ H2O
A)5
B)6
C)12
D)10
5
3
When the reaction shown is correctly balanced,the coefficients are:
HNO3 + KOH → KNO3 + H2O
A)0,0,0,0
B)1,1,1,1
C)2,2,2,2
D)3,1,1,3
E)2,1,2,1
HNO3 + KOH → KNO3 + H2O
A)0,0,0,0
B)1,1,1,1
C)2,2,2,2
D)3,1,1,3
E)2,1,2,1
1,1,1,1
4
The scientific principle which is the basis for balancing chemical equations is
A)the Law of Conservation of Energy.
B)the Law of Conservation of Mass.
C)the Law of Conservation of Mass and Energy.
D)the Law of Definite Proportions.
E)Avogadro's Law.
A)the Law of Conservation of Energy.
B)the Law of Conservation of Mass.
C)the Law of Conservation of Mass and Energy.
D)the Law of Definite Proportions.
E)Avogadro's Law.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
5
When the following reaction is balanced the coefficient in front of oxygen is:
____ C8H18 + ____ O2 → ____ CO2 + ____ H2O
A)25
B)12
C)18
D)9
____ C8H18 + ____ O2 → ____ CO2 + ____ H2O
A)25
B)12
C)18
D)9

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
6
When the reaction shown is correctly balanced,the coefficients are:
Li + Br2 → LiBr
A)1,1,1
B)1,2,2
C)1,2,1
D)2,2,1
E)2,1,2
Li + Br2 → LiBr
A)1,1,1
B)1,2,2
C)1,2,1
D)2,2,1
E)2,1,2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
7
In the correctly balanced reaction the coefficient for the H2O is:
____ Al(OH)3 + ____ H2SO4 → ____ Al2 (SO4)3 + ____ H2O
A)1
B)2
C)3
D)6
E)8
____ Al(OH)3 + ____ H2SO4 → ____ Al2 (SO4)3 + ____ H2O
A)1
B)2
C)3
D)6
E)8

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
8
In a precipitation reaction the insoluble product can be identified by the symbol ________.
A)(aq)
B)(l)
C)(g)
D)(s)
E)none of the above
A)(aq)
B)(l)
C)(g)
D)(s)
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
9
When the reaction shown is correctly balanced,the coefficients are:
C6H14 (l)+ O2 (g)→ CO2 (g)+ H2O (g)
A)1,6,6,7
B)2,19,12,14
C)1,3.5,6,7
D)1,9.5,6,7
E)2,16.5,12,7
C6H14 (l)+ O2 (g)→ CO2 (g)+ H2O (g)
A)1,6,6,7
B)2,19,12,14
C)1,3.5,6,7
D)1,9.5,6,7
E)2,16.5,12,7

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
10
When the reaction shown is balanced,there are ________ atoms of oxygen and ________ atoms of hydrogen on each side.
(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq)
A)6; 11
B)16; 18
C)8; 14
D)4; 7
E)16; 28
(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq)
A)6; 11
B)16; 18
C)8; 14
D)4; 7
E)16; 28

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
11
In a chemical reaction
A)there are equal numbers of atoms on each side of the reaction arrow.
B)there are equal numbers of molecules on each side of the reaction arrow.
C)there are always the same number of products as there are reactants.
D)the number of atoms present in a reaction can vary when the conditions change during the reaction.
E)none of the above
A)there are equal numbers of atoms on each side of the reaction arrow.
B)there are equal numbers of molecules on each side of the reaction arrow.
C)there are always the same number of products as there are reactants.
D)the number of atoms present in a reaction can vary when the conditions change during the reaction.
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
12
Which of the following equations is not balanced?
A)C7H16 + O2 → 7 CO2 + 8 H2O
B)K2CrO4 + Pb(NO3)2 → 2 KNO3 + PbCrO4
C)4 Fe3O4 + O2 → 6 Fe2O3
D)3 AgNO3 + (NH4)3PO4 → Ag3PO4 + 3 NH4NO3
E)2 Al2O3 → 4 Al + 3 O2
A)C7H16 + O2 → 7 CO2 + 8 H2O
B)K2CrO4 + Pb(NO3)2 → 2 KNO3 + PbCrO4
C)4 Fe3O4 + O2 → 6 Fe2O3
D)3 AgNO3 + (NH4)3PO4 → Ag3PO4 + 3 NH4NO3
E)2 Al2O3 → 4 Al + 3 O2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
13
The balanced equation for the reaction occurring when iron(III)oxide,a solid,is reduced with pure carbon to produce carbon dioxide and molten iron is
A)2 Fe3O + C (s)→ 6 Fe (l)+ CO2 (g).
B)2 FeO3 + 3 C (s)→ 2 Fe (l)+ 3 CO2 (g).
C)4 Fe2O3 + 6 C (s)→ 8 Fe (l)+ 6 CO2 (g).
D)2 FeO + C (s)→ 2 Fe (l)+ CO2 (g).
E)2 Fe2O3 + 3 C (s)→ 4 Fe (l)+ 3 CO2 (g).
A)2 Fe3O + C (s)→ 6 Fe (l)+ CO2 (g).
B)2 FeO3 + 3 C (s)→ 2 Fe (l)+ 3 CO2 (g).
C)4 Fe2O3 + 6 C (s)→ 8 Fe (l)+ 6 CO2 (g).
D)2 FeO + C (s)→ 2 Fe (l)+ CO2 (g).
E)2 Fe2O3 + 3 C (s)→ 4 Fe (l)+ 3 CO2 (g).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
14
The balanced equation for the reaction occurring when calcium nitrate solution is mixed with sodium phosphate solution is
A)3 Ca(NO3)2 (aq)+ 2 Na3PO4 (aq)→ Ca3(PO4)2 (aq)+ 6 NaNO3 (aq).
B)2 Ca(NO3)2 (aq)+ 3 Na3PO4 (aq)→ 2 Ca3(PO4)2 (s)+ 6 NaNO3 (aq).
C)3 CaNO3 (aq)+ Na3PO4 (aq)→ Ca3PO4 (aq)+ 3 NaNO3 (s).
D)3 Ca(NO3)2 (aq)+ 2 Na3PO4 (aq)→ Ca3(PO4)2 (s)+ 6 NaNO3 (aq).
E)Ca(NO3)2 (aq)+ 2 NaPO4 (aq)→ Ca(PO4)2 (s)+ 2 NaNO3 (aq).
A)3 Ca(NO3)2 (aq)+ 2 Na3PO4 (aq)→ Ca3(PO4)2 (aq)+ 6 NaNO3 (aq).
B)2 Ca(NO3)2 (aq)+ 3 Na3PO4 (aq)→ 2 Ca3(PO4)2 (s)+ 6 NaNO3 (aq).
C)3 CaNO3 (aq)+ Na3PO4 (aq)→ Ca3PO4 (aq)+ 3 NaNO3 (s).
D)3 Ca(NO3)2 (aq)+ 2 Na3PO4 (aq)→ Ca3(PO4)2 (s)+ 6 NaNO3 (aq).
E)Ca(NO3)2 (aq)+ 2 NaPO4 (aq)→ Ca(PO4)2 (s)+ 2 NaNO3 (aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
15
Which statement regarding balanced chemical equations is not true?
A)The number of each kind of atoms must be the same on each side.
B)Coefficients are used in front of formulas to balance the equation.
C)Subscripts may be changed to make an equation simpler to balance.
D)When no coefficient is written in front of a formula,the number "one" is assumed.
E)Reactants are written to the left of the arrow.
A)The number of each kind of atoms must be the same on each side.
B)Coefficients are used in front of formulas to balance the equation.
C)Subscripts may be changed to make an equation simpler to balance.
D)When no coefficient is written in front of a formula,the number "one" is assumed.
E)Reactants are written to the left of the arrow.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
16
Which is the correct equation for the reaction of magnesium with hydrochloric acid to produce hydrogen and magnesium chloride?
A)Mg + 2 HCl → H2 + MgCl2
B)Mg + HCl → H + MgCl
C)2 Mg + 6 HCl → 3 H2 + 2 MgCl2
D)Mg + 2 HCl → 2 H + MgCl2
E)Mg + 3 HCl → 3 H + MgCl2
A)Mg + 2 HCl → H2 + MgCl2
B)Mg + HCl → H + MgCl
C)2 Mg + 6 HCl → 3 H2 + 2 MgCl2
D)Mg + 2 HCl → 2 H + MgCl2
E)Mg + 3 HCl → 3 H + MgCl2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
17
When the reaction shown is correctly balanced,the coefficients are:
KClO3 → KCl + O2
A)1,1,1
B)2,2,2
C)2,2,3
D)2,2,1
E)4,4,6
KClO3 → KCl + O2
A)1,1,1
B)2,2,2
C)2,2,3
D)2,2,1
E)4,4,6

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
18
When the reaction shown is correctly balanced,the coefficients are:
____ HBr + ____ Ca(OH)2 → ____ CaBr2 + ____ H2O
A)2,1,1,1
B)1,1,1,2
C)2,1,1,2
D)2,2,1,1
E)2,1,2,2
____ HBr + ____ Ca(OH)2 → ____ CaBr2 + ____ H2O
A)2,1,1,1
B)1,1,1,2
C)2,1,1,2
D)2,2,1,1
E)2,1,2,2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
19
Consider the reaction shown and identify the statement that is not true.
CaCO3 (s)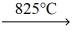
CaO (s)+ CO2 (g)
A)This reaction is balanced as written.
B)The reactant must be heated for this reaction to occur.
C)The products are a solid and a gas.
D)Water must be present for this reaction to occur.
E)There are no solutions used in this reaction.
CaCO3 (s)
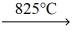
CaO (s)+ CO2 (g)
A)This reaction is balanced as written.
B)The reactant must be heated for this reaction to occur.
C)The products are a solid and a gas.
D)Water must be present for this reaction to occur.
E)There are no solutions used in this reaction.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
20
Which of the following equations is not balanced?
A)2 Na + 2 H2O → 2 NaOH + H2
B)C3H8 + 5 O2 → 3 CO2 + 4 H2O
C)2 H2 + O2 → 2 H2O
D)SO2 + O2 → SO3
E)2 Al + 6 HCl → 2 AlCl3 + 3 H2
A)2 Na + 2 H2O → 2 NaOH + H2
B)C3H8 + 5 O2 → 3 CO2 + 4 H2O
C)2 H2 + O2 → 2 H2O
D)SO2 + O2 → SO3
E)2 Al + 6 HCl → 2 AlCl3 + 3 H2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
21
Which reaction is an example of a precipitation reaction?
A)H2CO3 (aq)→ H2O (l)+ CO2 (g)
B)H2SO4 (aq)+ Ca(OH)2 (aq)→ CaSO4 (aq)+ 2 H2O (l)
C)6 HCl (aq)+ 2 Al (s)→ 2 AlCl3 (aq)+ 3 H2 (g)
D)FeCl3 (aq)+ 3 KOH (aq)→ Fe(OH)3 (s)+ 3 KCl (aq)
E)2 Hg (l)+ O2 (g)→ 2 HgO (s)
A)H2CO3 (aq)→ H2O (l)+ CO2 (g)
B)H2SO4 (aq)+ Ca(OH)2 (aq)→ CaSO4 (aq)+ 2 H2O (l)
C)6 HCl (aq)+ 2 Al (s)→ 2 AlCl3 (aq)+ 3 H2 (g)
D)FeCl3 (aq)+ 3 KOH (aq)→ Fe(OH)3 (s)+ 3 KCl (aq)
E)2 Hg (l)+ O2 (g)→ 2 HgO (s)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
22
The combination of ions least likely to produce a precipitate is
A)Ba2+ and SO42-.
B)Pb+ and Cl-.
C)Ca2+ and PO43-.
D)Fe3+ and OH-.
E)Mg2+ and C2H3O2-.
A)Ba2+ and SO42-.
B)Pb+ and Cl-.
C)Ca2+ and PO43-.
D)Fe3+ and OH-.
E)Mg2+ and C2H3O2-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
23
The combination of ions most likely to produce a precipitate is
A)Li+ and PO43-.
B)Pb2+ and NO3-.
C)NH4+ and SO42-.
D)Fe3+ and OH-.
E)Mg2+ and C2H3O2-.
A)Li+ and PO43-.
B)Pb2+ and NO3-.
C)NH4+ and SO42-.
D)Fe3+ and OH-.
E)Mg2+ and C2H3O2-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
24
Which reaction is not an example of a redox reaction?
A)2 Hg (l)+ O2 (g)→ 2 HgO (s)
B)2 (NH4)3PO4 (aq)+ 3 Ba(NO3)2 (aq)→ Ba3(PO4)2 (s)+ 6 NH4NO3 (aq)
C)CH4 (g)+ 2 O2 (g)→ CO2 (g)+ 2 H2O (g)
D)6 HCl (aq)+ 2 Al (s)→ 2 AlCl3 (aq)+ 3 H2 (g)
E)2 Al2O3 (s)→ 4 Al (s)+ 3 O2 (g)
A)2 Hg (l)+ O2 (g)→ 2 HgO (s)
B)2 (NH4)3PO4 (aq)+ 3 Ba(NO3)2 (aq)→ Ba3(PO4)2 (s)+ 6 NH4NO3 (aq)
C)CH4 (g)+ 2 O2 (g)→ CO2 (g)+ 2 H2O (g)
D)6 HCl (aq)+ 2 Al (s)→ 2 AlCl3 (aq)+ 3 H2 (g)
E)2 Al2O3 (s)→ 4 Al (s)+ 3 O2 (g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
25
When a substance loses electrons it is ________; the substance itself is acting as a(an)________ agent.
A)oxidized; oxidizing
B)oxidized; reducing
C)reduced; oxidizing
D)reduced; reducing
E)dissolved; neutralizing
A)oxidized; oxidizing
B)oxidized; reducing
C)reduced; oxidizing
D)reduced; reducing
E)dissolved; neutralizing

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
26
Fe(s)+ CuCl2 (aq)→ Cu(s)+ FeCl2 (aq)In the redox reaction shown,________ is oxidized and becomes ________.
A)Fe; Fe+
B)Fe; Fe2+
C)Cu; Cu2+
D)Cu2+; Cu
E)none of the above
A)Fe; Fe+
B)Fe; Fe2+
C)Cu; Cu2+
D)Cu2+; Cu
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
27
All of the statements regarding redox reactions are true except
A)a reducing agent causes another substance to be reduced.
B)halogens usually behave as oxidizing agents because they readily gain electrons.
C)metal ions are produced when pure metals are oxidized.
D)when a substance is oxidized its charge (or oxidation number)decreases.
E)alkali metals often behave as reducing agents because they readily lose electrons.
A)a reducing agent causes another substance to be reduced.
B)halogens usually behave as oxidizing agents because they readily gain electrons.
C)metal ions are produced when pure metals are oxidized.
D)when a substance is oxidized its charge (or oxidation number)decreases.
E)alkali metals often behave as reducing agents because they readily lose electrons.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
28
Which one of the following substances is produced during an acid/base (or neutralization)reaction?
A)H2
B)H2O
C)CO2
D)NaOH
E)NaCl
A)H2
B)H2O
C)CO2
D)NaOH
E)NaCl

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
29
Which reaction is an example of an acid-base reaction?
A)H2CO3 (aq)→ H2O(l)+ CO2 (g)
B)H2SO4 (aq)+ Ca(OH)2 (aq)→ CaSO4 (aq)+ 2 H2O(l)
C)6 HCl(aq)+ 2 Al(s)→ 2 AlCl3 (aq)+ 3 H2 (g)
D)FeCl3 (aq)+ 3 KOH(aq)→ Fe(OH)3 (s)+ 3 KCl(aq)
E)2 Hg(l)+ O2(g)→2 HgO(s)
A)H2CO3 (aq)→ H2O(l)+ CO2 (g)
B)H2SO4 (aq)+ Ca(OH)2 (aq)→ CaSO4 (aq)+ 2 H2O(l)
C)6 HCl(aq)+ 2 Al(s)→ 2 AlCl3 (aq)+ 3 H2 (g)
D)FeCl3 (aq)+ 3 KOH(aq)→ Fe(OH)3 (s)+ 3 KCl(aq)
E)2 Hg(l)+ O2(g)→2 HgO(s)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
30
All of the reactions shown are oxidation-reduction reactions except
A)N2 (g)+ O2(g)→ 2 NO(g).
B)2 Fe2O3 (s)→ 4 Fe(s)+ 3 O2(g).
C)Zn(s)+ 2 HCl(aq)→ ZnCl2 (aq)+ H2 (g).
D)2 NaI(aq)+ Cl2 (g)→ 2 NaCl(aq)+ I2.
E)K2SO4 (aq)+ BaCl2 (aq)→ BaSO4 (s)+ 2 KCl(aq).
A)N2 (g)+ O2(g)→ 2 NO(g).
B)2 Fe2O3 (s)→ 4 Fe(s)+ 3 O2(g).
C)Zn(s)+ 2 HCl(aq)→ ZnCl2 (aq)+ H2 (g).
D)2 NaI(aq)+ Cl2 (g)→ 2 NaCl(aq)+ I2.
E)K2SO4 (aq)+ BaCl2 (aq)→ BaSO4 (s)+ 2 KCl(aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
31
The balanced equation for the reaction between aqueous ammonium sulfate and aqueous barium acetate is
A)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq).
B)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ 2 NH4C2H3O2 (aq).
C)NH4SO4 (aq)+ BaC2H3O2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq).
D)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (aq)+ 2 NH4C2H3O2 (s).
E)(NH4)2SO3 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO3 (aq)+ NH4C2H3O2 (aq).
A)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq).
B)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (s)+ 2 NH4C2H3O2 (aq).
C)NH4SO4 (aq)+ BaC2H3O2 (aq)→ BaSO4 (s)+ NH4C2H3O2 (aq).
D)(NH4)2SO4 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO4 (aq)+ 2 NH4C2H3O2 (s).
E)(NH4)2SO3 (aq)+ Ba(C2H3O2)2 (aq)→ BaSO3 (aq)+ NH4C2H3O2 (aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
32
In the reaction shown,________ is the oxidizing agent because it ________.
Ni (s)+ CuCl2 (aq)→ Cu (s)+ NiCl2 (aq)
A)Ni; causes reduction
B)Ni; gets reduced
C)CuCl2; causes reduction
D)CuCl2; gets reduced
E)NiCl2; gets reduced
Ni (s)+ CuCl2 (aq)→ Cu (s)+ NiCl2 (aq)
A)Ni; causes reduction
B)Ni; gets reduced
C)CuCl2; causes reduction
D)CuCl2; gets reduced
E)NiCl2; gets reduced

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
33
Which of the following is not soluble in water?
A)potassium sulfide
B)iron(II)bromide
C)iron(III)hydroxide
D)iron(III)nitrate
E)ammonium sulfate
A)potassium sulfide
B)iron(II)bromide
C)iron(III)hydroxide
D)iron(III)nitrate
E)ammonium sulfate

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
34
The following reaction can be classified as what type(s)of reaction(s)?
2 Al(OH)3 (aq)+ 3 H2SO4 (aq)→ Al2(SO4)3 (s)+ 6 H2O (l)
A)precipitation
B)acid-base neutralization
C)redox reaction
D)both A and B
2 Al(OH)3 (aq)+ 3 H2SO4 (aq)→ Al2(SO4)3 (s)+ 6 H2O (l)
A)precipitation
B)acid-base neutralization
C)redox reaction
D)both A and B

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
35
The reaction 2 AgNO3 (aq)+ K2SO4 (aq)→ 2 KNO3 (aq)+ Ag2SO4 (s)is an example of a(an)________ reaction.
A)acid-base
B)oxidation-reduction
C)precipitation
D)combustion
E)none of the above
A)acid-base
B)oxidation-reduction
C)precipitation
D)combustion
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
36
Reduction is the process of
A)gaining hydrogen.
B)losing oxygen.
C)gaining electrons.
D)forming an anion from a neutral atom.
E)all of the above
A)gaining hydrogen.
B)losing oxygen.
C)gaining electrons.
D)forming an anion from a neutral atom.
E)all of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
37
When a solution of iron(III)nitrate is mixed with a solution of sodium hydroxide,a rust colored precipitate forms.This precipitate is probably
A)iron (III)nitrate.
B)sodium hydroxide.
C)sodium nitrate.
D)iron (III)hydroxide.
E)none of the above
A)iron (III)nitrate.
B)sodium hydroxide.
C)sodium nitrate.
D)iron (III)hydroxide.
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
38
Which reaction is an example of both a precipitation and a neutralization?
A)H3PO4 (aq)+ 3 KOH (aq)→ K3PO4 (aq)+ 3 H2O (l)
B)FeCl3 (aq)+ 3 KOH (aq)→ Fe(OH)3 (s)+ 3 KCl (aq)
C).(NH4)2CO3 (s)→ 2 NH3 (g)+ CO2 (g)+ H2O (l)
D)H2SO4 (aq)+ Ba(OH)2 (aq)→ BaSO4 (s)+ 2 H2O (l)
E)2 C (s)+ O2 (g)→ 2 CO (g)
A)H3PO4 (aq)+ 3 KOH (aq)→ K3PO4 (aq)+ 3 H2O (l)
B)FeCl3 (aq)+ 3 KOH (aq)→ Fe(OH)3 (s)+ 3 KCl (aq)
C).(NH4)2CO3 (s)→ 2 NH3 (g)+ CO2 (g)+ H2O (l)
D)H2SO4 (aq)+ Ba(OH)2 (aq)→ BaSO4 (s)+ 2 H2O (l)
E)2 C (s)+ O2 (g)→ 2 CO (g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
39
The formation of which one of the compounds below will act as the driving force for an acid-base reaction?
A)H2O
B)MgCl2
C)NaNO3
D)KOH
A)H2O
B)MgCl2
C)NaNO3
D)KOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
40
The element chlorine is very reactive as a(an)________ agent because it readily ________ electrons to form the chloride ion.
A)oxidizing; loses
B)oxidizing; gains
C)reducing; loses
D)reducing; gains
E)none of the above
A)oxidizing; loses
B)oxidizing; gains
C)reducing; loses
D)reducing; gains
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
41
Match the following.
LX (aq)+ MY (aq)→ LY (s)+ MX (aq)
A)redox
B)acid-base
C)precipitation
LX (aq)+ MY (aq)→ LY (s)+ MX (aq)
A)redox
B)acid-base
C)precipitation

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
42
What are the spectator ions in the reaction between KOH and HNO3?
A)K+ and H+
B)H+ and OH-
C)K+ and NO3-
D)H+and NO3-
A)K+ and H+
B)H+ and OH-
C)K+ and NO3-
D)H+and NO3-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
43
2 AgNO3 (aq)+ K2SO4 (aq)→ 2 KNO3 (aq)+ Ag2SO4 (s)
The spectator ions in the reaction shown are
A)silver ion and nitrate ion.
B)potassium ion and sulfate ion.
C)potassium ion and nitrate ion.
D)silver ion and sulfate ion.
E)hydrogen ion and hydroxide ion.
The spectator ions in the reaction shown are
A)silver ion and nitrate ion.
B)potassium ion and sulfate ion.
C)potassium ion and nitrate ion.
D)silver ion and sulfate ion.
E)hydrogen ion and hydroxide ion.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
44
Match the following.
M (s)+ 2 LX (aq)→ 2 L (s)+ MX2 (aq)
A)redox
B)acid-base
C)precipitation
M (s)+ 2 LX (aq)→ 2 L (s)+ MX2 (aq)
A)redox
B)acid-base
C)precipitation

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
45
Match the following.
HR (aq)+ XOH (aq)→ XR (aq)+ H2O (l)
A)redox
B)acid-base
C)precipitation
HR (aq)+ XOH (aq)→ XR (aq)+ H2O (l)
A)redox
B)acid-base
C)precipitation

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
46
2 AgNO3 (aq)+ K2SO4(aq)→ 2 KNO3 (aq)+ Ag2SO4s)
The net ionic reaction for the balanced equation shown above is
A)Ag+ +
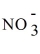
→ AgNO3.
B)2 K+ +
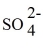
→ K2SO4.
C)K+ +
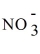
→ KNO3.
D)2 Ag+ +
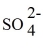
→ Ag2SO4.
E)H+ + OH- → H2O.
The net ionic reaction for the balanced equation shown above is
A)Ag+ +
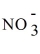
→ AgNO3.
B)2 K+ +
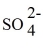
→ K2SO4.
C)K+ +
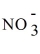
→ KNO3.
D)2 Ag+ +
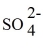
→ Ag2SO4.
E)H+ + OH- → H2O.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
47
In the following reaction which species is being oxidized and which is being reduced?
2 Cr (s)+ 3 Cl2 (g)→ 2 CrCl3 (s)
A)oxidized: Cr; reduced: CrCl3
B)oxidized:CrCl3; reduced: Cr
C)oxidized: Cr; reduced: Cl2
D)oxidized: Cl2; reduced: Cr
2 Cr (s)+ 3 Cl2 (g)→ 2 CrCl3 (s)
A)oxidized: Cr; reduced: CrCl3
B)oxidized:CrCl3; reduced: Cr
C)oxidized: Cr; reduced: Cl2
D)oxidized: Cl2; reduced: Cr

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
48
The net ionic equation for the reaction between zinc and hydrochloric acid solution is
A)Zn (s)+ 2 H+ (aq)→ Zn2+ (aq)+ H2 (g).
B)Zn (s)+ 2 HCl (aq)→ ZnCl2 (aq)+ H2 (g).
C)Zn2+ (aq)+ H2 (g)→ ZnS (s)+ 2 H+ (aq).
D)ZnCl2 (aq)+ H2 (g)→ ZnS (s)+ 2 HCl (aq).
E)none of these
A)Zn (s)+ 2 H+ (aq)→ Zn2+ (aq)+ H2 (g).
B)Zn (s)+ 2 HCl (aq)→ ZnCl2 (aq)+ H2 (g).
C)Zn2+ (aq)+ H2 (g)→ ZnS (s)+ 2 H+ (aq).
D)ZnCl2 (aq)+ H2 (g)→ ZnS (s)+ 2 HCl (aq).
E)none of these

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
49
The oxidation number of sulfur in calcium sulfate,CaSO4,is ________.
A)+6
B)+4
C)+2
D)0
E)-2
A)+6
B)+4
C)+2
D)0
E)-2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
50
Which of the following is always a spectator ion in a chemical reaction?
A)Na+
B)Cl-
C)S2-
D)Mg2+
E)All of these ions.
A)Na+
B)Cl-
C)S2-
D)Mg2+
E)All of these ions.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
51
As a pure element the oxidation number of zinc is ________,but in compounds such as ZnCO3 its oxidation number is ________.
A)0; 0
B)0; +1
C)+1; 0
D)0; +2
E)none of the above
A)0; 0
B)0; +1
C)+1; 0
D)0; +2
E)none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
52
The oxidation number of chlorine in the compound FeCl3 is ________.
A)-3
B)-2
C)-1
D)+2
E)+3
A)-3
B)-2
C)-1
D)+2
E)+3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck
53
The oxidation number of iron in the compound FeBr3 is ________.
A)-2
B)-1
C)+1
D)+2
E)+3
A)-2
B)-1
C)+1
D)+2
E)+3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 53 في هذه المجموعة.
فتح الحزمة
k this deck








