Deck 12: Acids and Bases
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/94
العب
ملء الشاشة (f)
Deck 12: Acids and Bases
1
Which of the following is the weakest acid?
A)HNO3
B)HBr
C)HCl
D)HF
E)HI
A)HNO3
B)HBr
C)HCl
D)HF
E)HI
HF
2
What is the conjugate base of H2PO4- ?
A)HPO42-
B)OH-
C)H3PO4
D)H2PO4-
E)PO43-
A)HPO42-
B)OH-
C)H3PO4
D)H2PO4-
E)PO43-
HPO42-
3
The conjugate acid of HPO42- is
A)HPO42-.
B)PO43-.
C)H2PO4-.
D)H3O+.
E)H3PO4.
A)HPO42-.
B)PO43-.
C)H2PO4-.
D)H3O+.
E)H3PO4.
H2PO4-.
4
In the following reaction
SO2(g)+ H2O(l) H2SO3(aq),
identify the Lewis acid and base.
SO2(g)+ H2O(l) H2SO3(aq),
identify the Lewis acid and base.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
5
When sulfur trioxide dissolves in water,sulfuric acid is produced.An intermediate in the reaction is H2O-SO3.In the reaction of the intermediate to produce sulfuric acid,
A)water acts both as an acid and a base.
B)water acts as a proton donor only.
C)water acts as a proton acceptor only.
D)the intermediate undergoes an intramolecular rearrangement to form the product.
A)water acts both as an acid and a base.
B)water acts as a proton donor only.
C)water acts as a proton acceptor only.
D)the intermediate undergoes an intramolecular rearrangement to form the product.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
6
The pH of a 0.0050 M aqueous solution of calcium hydroxide is
A)11.40
B)2.00
C)12.00
D)12.70
E)11.70
A)11.40
B)2.00
C)12.00
D)12.70
E)11.70

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
7
What is the pKa of the conjugate acid of hydrazine,given that the pKb of hydrazine is 5.77? Write the formula of the conjugate acid of hydrazine.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
8
The conjugate base of OH- is
A)H+.
B)OH-.
C)O2-.
D)H3O+.
E)H2O.
A)H+.
B)OH-.
C)O2-.
D)H3O+.
E)H2O.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
9
Which of the following is the weakest acid?
A)HCN (pKa = 9.31)
B)HIO3 (pKa = 0.77)
C)HF (pKa = 3.45)
D)CH3COOH (pKa = 4.75)
E)HNO2 (pKa = 3.37)
A)HCN (pKa = 9.31)
B)HIO3 (pKa = 0.77)
C)HF (pKa = 3.45)
D)CH3COOH (pKa = 4.75)
E)HNO2 (pKa = 3.37)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
10
In a solution labeled "0.10 M HNO3," which of the following is correct?
A)[HNO3] = 0.10 M
B)[H3O+] = 0.10 M,[NO3-] = 0.10 M
C)[H3O+] = 0.090 M,[NO3-] = 0.010 M
D)[HNO3] = 0.050 M,[H3O+] = 0.050 M,[NO3-] = 0.050 M
E)[H3O+] = 0.10 M,[OH-] = 1.0 * 10-7 M
A)[HNO3] = 0.10 M
B)[H3O+] = 0.10 M,[NO3-] = 0.10 M
C)[H3O+] = 0.090 M,[NO3-] = 0.010 M
D)[HNO3] = 0.050 M,[H3O+] = 0.050 M,[NO3-] = 0.050 M
E)[H3O+] = 0.10 M,[OH-] = 1.0 * 10-7 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
11
The conjugate base of ammonia is
A)NH2OH.
B)NH2-.
C)NH4+.
D)NH3.
E)OH-.
A)NH2OH.
B)NH2-.
C)NH4+.
D)NH3.
E)OH-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
12
Calculate the hydroxide ion concentration for an aqueous solution that has a pH of 3.45.
A)3.2 * 10-2 M
B)0.54 M
C)3.5 * 10-4 M
D)2.8 * 10-11 M
E)2.6 * 10-5 M
A)3.2 * 10-2 M
B)0.54 M
C)3.5 * 10-4 M
D)2.8 * 10-11 M
E)2.6 * 10-5 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
13
Of the following,which does not have an amphoteric oxide?
A)BeO
B)PbO
C)SnO
D)Al2O3
E)MgO
A)BeO
B)PbO
C)SnO
D)Al2O3
E)MgO

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
14
Strong acids are leveled in water to the strength of the acid H3O+.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
15
All of the following are strong bases in water except
A)NaHCO3
B)CaO
C)Na2O
D)Na2SO4
A)NaHCO3
B)CaO
C)Na2O
D)Na2SO4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
16
Calculate the hydrogen ion concentration for an aqueous solution that has a pH of 3.45.
A)0.54 M
B)3.5 * 10-4 M
C)2.8 * 10-11
D)3.2 * 10-2 M
E)1.22 M
A)0.54 M
B)3.5 * 10-4 M
C)2.8 * 10-11
D)3.2 * 10-2 M
E)1.22 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
17
Which of the following is the strongest base?
A)methylamine (pKb = 3.44)
B)morphine (pKb = 5.79)
C)urea (pKb = 13.90)
D)ammonia (pKb = 4.75)
E)pyridine (pKb = 8.75)
A)methylamine (pKb = 3.44)
B)morphine (pKb = 5.79)
C)urea (pKb = 13.90)
D)ammonia (pKb = 4.75)
E)pyridine (pKb = 8.75)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
18
What is the conjugate acid of O2-?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
19
Write the autoprotolysis reaction for liquid ammonia.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
20
Which of the following produces the strongest conjugate base?
A)HF (pKa = 3.45)
B)HClO (pKa = 7.53)
C)HCOOH (pKa = 3.75)
D)CH3COOH (pKa = 4.75)
E)HIO (pKa = 10.64)
A)HF (pKa = 3.45)
B)HClO (pKa = 7.53)
C)HCOOH (pKa = 3.75)
D)CH3COOH (pKa = 4.75)
E)HIO (pKa = 10.64)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
21
What is the pH of 0.025 M (CH3)3N(aq)(Kb = 6.5 * 10-5)?
A)11.91
B)12.40
C)11.11
D)8.29
E)9.81
A)11.91
B)12.40
C)11.11
D)8.29
E)9.81

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
22
Which of the following 0.10 M aqueous solutions gives the lowest pH?
A)CCl3COOH (pKa = 0.52)
B)Because all are acids,the pH is the same for all solutions.
C)HF (pKa = 3.45)
D)CH3COOH (pKa = 4.75)
E)H3PO4 (pKa1 = 2.12)
A)CCl3COOH (pKa = 0.52)
B)Because all are acids,the pH is the same for all solutions.
C)HF (pKa = 3.45)
D)CH3COOH (pKa = 4.75)
E)H3PO4 (pKa1 = 2.12)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
23
For a 0.10 M solution of a weak acid,HA,with pKa = 10,which of the following is true?
A)[HA] 0
B)[HA] = [A-]
C)[HA] = [H3O+]
D)[HA] = Ka
E)[HA] [H3O+]
A)[HA] 0
B)[HA] = [A-]
C)[HA] = [H3O+]
D)[HA] = Ka
E)[HA] [H3O+]

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
24
In liquid ammonia,the base B is a strong base if it is a stronger proton acceptor than NH2-.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
25
When CaO(s)is dissolved in water,which of the following is true?
A)The solution contains O2-(aq),OH-(aq),and Ca2+(aq).
B)The solution contains CaO(aq).
C)CaO(s)does not dissolve in water.
D)The solution contains O2-(aq)and Ca2+(aq).
E)The solution contains OH-(aq)and Ca2+(aq).
A)The solution contains O2-(aq),OH-(aq),and Ca2+(aq).
B)The solution contains CaO(aq).
C)CaO(s)does not dissolve in water.
D)The solution contains O2-(aq)and Ca2+(aq).
E)The solution contains OH-(aq)and Ca2+(aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
26
Which of the following aqueous solutions gives a pH greater than 7?
A)10-8 M NH4Cl
B)None of the solutions gives a pH greater than 7.
C)10-8 M CH3COOH
D)10-8 M HCl
E)10-8 M HCOOH
A)10-8 M NH4Cl
B)None of the solutions gives a pH greater than 7.
C)10-8 M CH3COOH
D)10-8 M HCl
E)10-8 M HCOOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
27
Estimate the pH of 10-7 M HClO4(aq).
A)6.8
B)8.0
C)1.0
D)5.0
E)7.0
A)6.8
B)8.0
C)1.0
D)5.0
E)7.0

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
28
In liquid ammonia,the acid HB is a strong acid if it is a weaker proton donor than NH4+.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
29
A flask of 0.25 M HBrO(aq)has what pH? (pKa = 8.69)
A)5.90
B)0.60
C)8.10
D)4.65
E)9.30
A)5.90
B)0.60
C)8.10
D)4.65
E)9.30

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
30
If the pKa of acetic acid is 4.75,the pKa of CH3CH2OH is
A)about 4.
B)much less than 4.75.
C)about 16.
D)also 4.75.
E)about 7.
A)about 4.
B)much less than 4.75.
C)about 16.
D)also 4.75.
E)about 7.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
31
If the value of Kb for pyridine is 1.8 * 10-9,calculate the equilibrium constant for C5H5NH+(aq)+ H2O(l)↔ C5H5N(aq)+ H3O+(aq)
A)-1.8 * 10-9
B)1.8 *10-16
C)5.6 * 108
D)1.8 * 10-9
E)5.6 * 10-6
A)-1.8 * 10-9
B)1.8 *10-16
C)5.6 * 108
D)1.8 * 10-9
E)5.6 * 10-6

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
32
Which of the following is the strongest acid?
A)CH3CH2OH
B)CH3COOH
C)CHCl2COOH
D)CH2ClCOOH
E)CCl3COOH
A)CH3CH2OH
B)CH3COOH
C)CHCl2COOH
D)CH2ClCOOH
E)CCl3COOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
33
Which of the following 0.10 M aqueous solutions has the lowest pH?
A)B(OH)3
B)HIO
C)C2H5NH3Cl
D)C6H5OH
A)B(OH)3
B)HIO
C)C2H5NH3Cl
D)C6H5OH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
34
Write the charge balance equation for a dilute aqueous solution of HI.
A)[I-] = [OH-] + [H3O+]
B)[H3O+] = [OH-]
C)[H3O+] = [I-]
D)[H3O+] = [I-] + [OH-]
E)[HI]initial = [I-]
A)[I-] = [OH-] + [H3O+]
B)[H3O+] = [OH-]
C)[H3O+] = [I-]
D)[H3O+] = [I-] + [OH-]
E)[HI]initial = [I-]

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
35
The pH of 0.80 M benzenesulfonic acid is 0.51.What is the percentage ionization of benzenesulfonic acid?
A)25%
B)39%
C)51%
D)5.0%
E)64%
A)25%
B)39%
C)51%
D)5.0%
E)64%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
36
The pH of 0.800 M aqueous benzenesulfonic acid is 0.51.What is the value of Ka for benzenesulfonic acid?
A)0.19
B)0.12
C)0.90
D)0.44
E)0.51
A)0.19
B)0.12
C)0.90
D)0.44
E)0.51

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
37
For the following acids,which has the highest pKa?
A)HIO
B)HClO3
C)HClO
D)HBrO
E)HClO4
A)HIO
B)HClO3
C)HClO
D)HBrO
E)HClO4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
38
The pH of 0.010 M aniline(aq)is 8.32.What is the percentage aniline protonated?
A)2.1%
B)0.69%
C)0.021%
D)0.12%
E)0.21%
A)2.1%
B)0.69%
C)0.021%
D)0.12%
E)0.21%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
39
Write the charge balance equation for a dilute aqueous solution of KOH.
A)[KOH]initial = [K+]
B)[OH-] = [H3O+] + [K+]
C)[H3O+] = [OH-]
D)[K+] = [OH-] + [H3O+]
E)[OH-] = [K+]
A)[KOH]initial = [K+]
B)[OH-] = [H3O+] + [K+]
C)[H3O+] = [OH-]
D)[K+] = [OH-] + [H3O+]
E)[OH-] = [K+]

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
40
The pH of 0.10 M pyridine(aq)is 9.13.What is the value of Kb for pyridine?
A)2.7 * 10-4
B)7.4 * 10-10
C)2.7 * 10-5
D)1.8 * 10-10
E)1.8 * 10-9
A)2.7 * 10-4
B)7.4 * 10-10
C)2.7 * 10-5
D)1.8 * 10-10
E)1.8 * 10-9

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
41
The following 0.1 M aqueous solutions are arranged in order of increasing pH,with the highest pH on the far right. 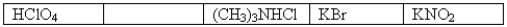 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
A)NaI
B)HCOOH
C)C6H5NH2
D)CH3NH3Cl
E)NaClO
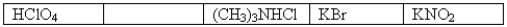 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?A)NaI
B)HCOOH
C)C6H5NH2
D)CH3NH3Cl
E)NaClO

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
42
The following 0.1 M aqueous solutions are arranged in order of increasing pH,with the highest pH on the far right.  Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
A)NaCN
B)CH3COOH
C)KNO2
D)NaBr
E)NaHSO4
 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?A)NaCN
B)CH3COOH
C)KNO2
D)NaBr
E)NaHSO4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
43
For a solution labeled "0.10 M H2SO3(aq)," pKa1 = 1.81 and pKa2 = 6.91,which of the following is true?
A)[H+] = 0.2 M.
B)The pH is 1.0.
C)The pH ~1.5.
D)The pH is 0.70.
E)The pH ~ 4.4.
A)[H+] = 0.2 M.
B)The pH is 1.0.
C)The pH ~1.5.
D)The pH is 0.70.
E)The pH ~ 4.4.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
44
The Ka of phenol is 1.3 * 10-10.For a solution labeled "1.0 *10-3 M aqueous phenol,"
A)Kw/[H3O+] >> [phenol]initial.
B)Kw/[H3O+] << [phenol]initial.
C)[H3O+] > 10-6.
D)pH ~ 4.
E)[H3O+] = [H3O+]2/[phenol]initial.
A)Kw/[H3O+] >> [phenol]initial.
B)Kw/[H3O+] << [phenol]initial.
C)[H3O+] > 10-6.
D)pH ~ 4.
E)[H3O+] = [H3O+]2/[phenol]initial.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
45
If pKa1 and pKa2 for H2CO3 are 6.37 and 10.25,respectively,calculate the equilibrium constant for the reaction below: H2CO3(aq)+ 2H2O(l)↔ 2H3O+(aq)+ CO32-(aq)
A)4.1 * 10-11
B)4.3 * 10-7
C)5.6 *10-11
D)2.3 * 10-8
E)2.4 * 10-17
A)4.1 * 10-11
B)4.3 * 10-7
C)5.6 *10-11
D)2.3 * 10-8
E)2.4 * 10-17

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
46
The equation that represents Ka2 for phosphoric acid is
A)HPO42-(aq)+ H2O(l)↔ PO43-(aq)+ H3O+(aq)
B)H2PO4(aq)+ H2O(l)↔ HPO42(aq)+ H3O+(aq).
C)H3PO4(aq)+ 2H2O(l)↔ HPO42-(aq)+ 2H3O+(aq).
D)HPO42-(aq)+ H2O(l)↔ H2PO4-(aq)+ OH-(aq).
E)H3PO4(aq)+ H2O(l)↔ H2PO4-(aq)+ H3O+(aq).
A)HPO42-(aq)+ H2O(l)↔ PO43-(aq)+ H3O+(aq)
B)H2PO4(aq)+ H2O(l)↔ HPO42(aq)+ H3O+(aq).
C)H3PO4(aq)+ 2H2O(l)↔ HPO42-(aq)+ 2H3O+(aq).
D)HPO42-(aq)+ H2O(l)↔ H2PO4-(aq)+ OH-(aq).
E)H3PO4(aq)+ H2O(l)↔ H2PO4-(aq)+ H3O+(aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
47
A 0.0010 M solution of a weak acid,HA,with Ka = 2 * 10-10 produces [H3O+] < 10-6 M.Which of the following equations can be used to determine [H3O+]?
A)The acid is so weak that the pH is about 7.
B)[H3O+]2 + Ka [H3O+] - [HA]initialKa = 0
C)[H3O+] = (Kw + Ka[HA]initial)½
D)[H3O+] = [HA]initial
E)[H3O+] = (Ka[HA]initial)½
A)The acid is so weak that the pH is about 7.
B)[H3O+]2 + Ka [H3O+] - [HA]initialKa = 0
C)[H3O+] = (Kw + Ka[HA]initial)½
D)[H3O+] = [HA]initial
E)[H3O+] = (Ka[HA]initial)½

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
48
Calculate the equilibrium concentration of sulfurous acid in a solution labeled "0.100 M H2SO3(aq)" if pKa1 = 1.81,and pKa2 = 6.91.
A)0.068 M
B)0.015 M
C)0.100 M
D)0.050 M
E)0.032 M
A)0.068 M
B)0.015 M
C)0.100 M
D)0.050 M
E)0.032 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
49
The equation that represents Ka2 for sulfurous acid is
A)HSO3-(aq)+ H2O(l)↔ H2SO3(aq)+ OH-(aq).
B)HSO3-(aq)+ H2O(l)↔ SO32-(aq)+ H3O+(aq).
C)H2SO3(aq)+ 2H2O(l)↔ SO32-(aq)+ 2H3O+(aq).
D)SO32-(aq)+ H2O(l)↔ HSO3-(aq)+ OH-(aq).
E)H2SO3(aq)+ H2O(l)↔ HSO3-(aq)+ H3O+(aq).
A)HSO3-(aq)+ H2O(l)↔ H2SO3(aq)+ OH-(aq).
B)HSO3-(aq)+ H2O(l)↔ SO32-(aq)+ H3O+(aq).
C)H2SO3(aq)+ 2H2O(l)↔ SO32-(aq)+ 2H3O+(aq).
D)SO32-(aq)+ H2O(l)↔ HSO3-(aq)+ OH-(aq).
E)H2SO3(aq)+ H2O(l)↔ HSO3-(aq)+ H3O+(aq).

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
50
Estimate the pH of 10-7 M KOH(aq).
A)6.9
B)9
C)13
D)7.2
E)7.0
A)6.9
B)9
C)13
D)7.2
E)7.0

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
51
What is the [H+] for a solution labeled "0.0500 M H2SO3(aq)" if pKa1 = 1.81,and pKa2 = 6.91?
A)0.021 M
B)0.029 M
C)0.015 M
D)0.025 M
E)0.050 M
A)0.021 M
B)0.029 M
C)0.015 M
D)0.025 M
E)0.050 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
52
The following 0.1 M aqueous solutions are arranged in order of increasing pH,with the highest pH on the far right.  Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
A)NH4Cl
B)NaCN
C)Al2(SO4)3
D)CH3NH2
E)CH3COOH
 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?A)NH4Cl
B)NaCN
C)Al2(SO4)3
D)CH3NH2
E)CH3COOH

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
53
If pKa1 and pKa2 for H2S are 6.88 and 14.15,respectively,calculate the equilibrium constant for the reaction below: H2S(aq)+ 2H2O(l)↔ 2H3O+(aq)+ S2-(aq)
A)1.3 * 10-7
B)1.1 * 10-7
C)7.7 * 10*8
D)9.2 *10-22
E)7.1 * 10-15
A)1.3 * 10-7
B)1.1 * 10-7
C)7.7 * 10*8
D)9.2 *10-22
E)7.1 * 10-15

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
54
Calculate the equilibrium constant for the reaction HS-(aq)+ H2O(l)↔ H2S(aq)+ OH-(aq),
Given Ka1 = 1.3 * 10-7 and Ka2 = 7.1 * 10-15 for H2S.
A)1.3 * 10-7
B)7.7 *10-8
C)9.2 *10-22
D)7.1 * 10-15
E)1.4
Given Ka1 = 1.3 * 10-7 and Ka2 = 7.1 * 10-15 for H2S.
A)1.3 * 10-7
B)7.7 *10-8
C)9.2 *10-22
D)7.1 * 10-15
E)1.4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
55
For a solution labeled "0.10 M H3PO4(aq),"
A)[H2PO4-] is greater than 0.10 M.
B)[H+] = 0.30 M.
C)[PO43-] = 0.10 M.
D)[H+] = 0.10 M.
E)[H+] is less than 0.10 M.
A)[H2PO4-] is greater than 0.10 M.
B)[H+] = 0.30 M.
C)[PO43-] = 0.10 M.
D)[H+] = 0.10 M.
E)[H+] is less than 0.10 M.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
56
The following 0.1 M aqueous solutions are arranged in order of increasing pH,with the highest pH on the far right.  Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
A)NaHSO4
B)KF
C)HNO2
D)CH3NH2
E)(CH3)3NHCl
 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?A)NaHSO4
B)KF
C)HNO2
D)CH3NH2
E)(CH3)3NHCl

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
57
For a solution labeled "0.10 M H2SO4(aq),"
A)[HSO4-] is greater than 0.10 M.
B)the pH is less than 1.0.
C)[SO42-] = 0.10 M.
D)the pH equals 1.0.
E)the pH is greater than 1.0.
A)[HSO4-] is greater than 0.10 M.
B)the pH is less than 1.0.
C)[SO42-] = 0.10 M.
D)the pH equals 1.0.
E)the pH is greater than 1.0.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
58
The Ka of phenol is 1.3 * 10-10.For a solution labeled "1.0 * 10-3 M aqueous phenol,"
A)[H3O+] = [H3O+]2/[phenol]initial.
B)[H3O+] << [phenol]initial.
C)[H3O+] > 10-6.
D)pH ~ 4.
E)Kw/[H3O+] >> [phenol]initial.
A)[H3O+] = [H3O+]2/[phenol]initial.
B)[H3O+] << [phenol]initial.
C)[H3O+] > 10-6.
D)pH ~ 4.
E)Kw/[H3O+] >> [phenol]initial.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
59
The following 0.1 M aqueous solutions are arranged in order of increasing pH,with the highest pH on the far right.  Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
A)CuSO4
B)NaNO2
C)CH3NH2
D)NaHCO3
E)Na2HPO4
 Which one of the following 0.10 M aqueous solutions should be placed in the empty box?
Which one of the following 0.10 M aqueous solutions should be placed in the empty box?A)CuSO4
B)NaNO2
C)CH3NH2
D)NaHCO3
E)Na2HPO4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
60
Write the charge balance equation for a solution that is 0.0010 M phenol(aq).Let phenol be represented by HA(aq).
A)[H3O+] = [OH-]
B)Kw = [H3O+][OH-]
C)[H3O+] = [OH-] + [A-]
D)Ka = Kw/Kb
E)0.0010 = [HA] + [A-]
A)[H3O+] = [OH-]
B)Kw = [H3O+][OH-]
C)[H3O+] = [OH-] + [A-]
D)Ka = Kw/Kb
E)0.0010 = [HA] + [A-]

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
61
In a solution labeled "0.0018 M barium hydroxide" what is the molarity of OH-?
A)0.0018 M
B)0.00090 M
C)0.0036 M
D)0.0072 M
E)None of the above.
A)0.0018 M
B)0.00090 M
C)0.0036 M
D)0.0072 M
E)None of the above.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
62
The pH of 0.010 M H3PO4(aq)is 2.24; estimate the concentration of PO43- in the solution.For H3PO4,the values of Ka1,Ka2,and Ka3 are 7.6 *10-3,6.2 * 10-8,and 2.1 * 10-13,respectively.
A)5.8 * 10-3 M
B)2.1 * 10-13 M
C)7.6 * 10-3 M
D)6.2 * 10-8 M
E)2.3 * 10-18 M
A)5.8 * 10-3 M
B)2.1 * 10-13 M
C)7.6 * 10-3 M
D)6.2 * 10-8 M
E)2.3 * 10-18 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
63
Calculate the equilibrium constant for the reaction S2-(aq)+ H2O(l)↔ HS-(aq)+ OH-(aq),
Given Ka1 = 1.3 * 10-7 and Ka2 = 7.1 * 10-15 for H2S.
A)1.3 * 10-7
B)9.2 * 10-22
C)7.7 * 10-8
D)7.1 * 10-15
E)1.4
Given Ka1 = 1.3 * 10-7 and Ka2 = 7.1 * 10-15 for H2S.
A)1.3 * 10-7
B)9.2 * 10-22
C)7.7 * 10-8
D)7.1 * 10-15
E)1.4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
64
If (HSO3-)= 0.83 at pH 2.5,what are (H2SO3)and (SO32-)at this pH? For H2SO3,pKa1 and pKa2 are 1.81 and 6.91,respectively.
A) (H2SO3)~ 0 and (SO32-)= 0.17
B) (H2SO3)= 0.415 and (SO32-)~ 0
C) (H2SO3)= 0.0.085 and (SO32-)= 0.085
D) (H2SO3)= 0.17 and (SO32-)~ 0
E) (H2SO3)= 0.17 and (SO32-)~ 1
A) (H2SO3)~ 0 and (SO32-)= 0.17
B) (H2SO3)= 0.415 and (SO32-)~ 0
C) (H2SO3)= 0.0.085 and (SO32-)= 0.085
D) (H2SO3)= 0.17 and (SO32-)~ 0
E) (H2SO3)= 0.17 and (SO32-)~ 1

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
65
The amino acid alanine,HOOC-CH(CH3)NH3+,has Ka1 = 4.5 * 10-3 and Ka2 = 1.4 * 10-10.Calculate (-OOC-CH(CH3)NH3+)at pH 3.
A)0
B)0.82
C)0.18
D)0.29
E)0.58
A)0
B)0.82
C)0.18
D)0.29
E)0.58

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
66
The fractional composition diagram for the amino acid alanine is given below. 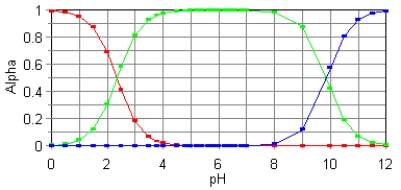 Write the structure of the dominant species at pH 1,6,and 12,respectively.
Write the structure of the dominant species at pH 1,6,and 12,respectively.
 Write the structure of the dominant species at pH 1,6,and 12,respectively.
Write the structure of the dominant species at pH 1,6,and 12,respectively.
فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
67
The pH of 0.010 M H3PO4(aq)is 2.24.Estimate the concentration of HPO42- in the solution.For H3PO4,the values of Ka1,Ka2,and Ka3 are 7.6 * 10-3,6.2 * 10-8,and 2.1 *10-13,respectively.
A)5.8 * 10-3 M
B)7.6 * 10-3 M
C)0.010 M
D)6.2 * 10-8 M
E)2.1 *10-13 M
A)5.8 * 10-3 M
B)7.6 * 10-3 M
C)0.010 M
D)6.2 * 10-8 M
E)2.1 *10-13 M

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
68
Estimate the pH of 0.10 M Na2HPO4(aq)given pKa1 = 2.12,pKa2 = 7.21,and pKa3 = 12.68 for phosphoric acid.
A)12.68
B)9.94
C)7.40
D)4.67
E)2.12
A)12.68
B)9.94
C)7.40
D)4.67
E)2.12

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
69
The amino acid alanine,HOOC-CH(CH3)NH3+,has Ka1 = 4.5 * 10-3 and Ka2 = 1.4 * 10-10.Calculate (HOOC-CH(CH3)NH3+)at pH 3.
A)0
B)0.82
C)0.58
D)0.29
E)0.18
A)0
B)0.82
C)0.58
D)0.29
E)0.18

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
70
All of the following are Lewis bases except
A)OH-
B)H2O
C)SO3
D)Br-
A)OH-
B)H2O
C)SO3
D)Br-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
71
the pH of 0.10 M and 0.40 M NaHCO3(aq)solutions is 8.31 for both?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
72
If (HSO3-)= 0.45 at pH 7.0,what are (H2SO3)and (SO32-)at this pH? For H2SO3,pKa1 and pKa2 are 1.81 and 6.91,respectively.
A) (H2SO3)= 0.225 and (SO32-)= 0.55
B) (H2SO3)= 0.55 and (SO32-)~ 0
C) (H2SO3)~ 0 and (SO32-)= 0.225
D) (H2SO3)~ 0 and SO32-)= 0.55
E) (H2SO3)= 0.45 and (SO32-)= 0.55
A) (H2SO3)= 0.225 and (SO32-)= 0.55
B) (H2SO3)= 0.55 and (SO32-)~ 0
C) (H2SO3)~ 0 and (SO32-)= 0.225
D) (H2SO3)~ 0 and SO32-)= 0.55
E) (H2SO3)= 0.45 and (SO32-)= 0.55

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
73
Of the following,which is not a Lewis acid?
A)H3O+
B)SO3
C)NO2-
D)BF3
E)None of the above.
A)H3O+
B)SO3
C)NO2-
D)BF3
E)None of the above.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
74
The amino acid methionine,HOOC-CH(CH2CH2SCH3)NH3+,has pKa1 = 2.2 and pKa2 = 9.1.If this amino acid is represented by H2L+,the major species at pH 6 is
A)HL
B)H2L+
C)L-
D)HL and L-
A)HL
B)H2L+
C)L-
D)HL and L-

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
75
The amino acid alanine,HOOC-CH(CH3)NH3+,has Ka1 = 4.5 * 10-3 and Ka2 = 1.4 * 10-10.Calculate (-OOC-CH(CH3)NH3+)at pH 10.
A)0.42
B)0.29
C)1.0
D)0
E)0.58
A)0.42
B)0.29
C)1.0
D)0
E)0.58

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
76
For a solution of phosphoric acid,write the equation for (HPO42-).
A)Ka3/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
B)[H3O+]/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
C)Ka1Ka2[H3O+]/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
D)Ka1Ka2Ka3/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
E)Ka1[H3O+]2/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
A)Ka3/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
B)[H3O+]/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
C)Ka1Ka2[H3O+]/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
D)Ka1Ka2Ka3/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)
E)Ka1[H3O+]2/([H3O+]3 + Ka1[H3O+]2 + Ka1Ka2[H3O+] + Ka1Ka2Ka3)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
77
The boxes below contain a series of 0.1 M aqueous solutions of increasing pH where A is the solution of lowest pH and E is the solution of highest pH.  Match each box with the correct compound.
Match each box with the correct compound.
phenol,pKa = 9.89
cyanide ion,pKb = 4.69
pyridine,pKb = 8.75
hydrogen sulfate ion,pKa = 1.92
sodium nitrate
 Match each box with the correct compound.
Match each box with the correct compound.phenol,pKa = 9.89
cyanide ion,pKb = 4.69
pyridine,pKb = 8.75
hydrogen sulfate ion,pKa = 1.92
sodium nitrate

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
78
The fractional composition diagram for the amino acid alanine is shown below. 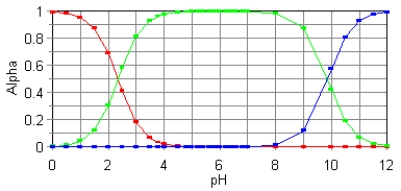 What do the two points represent where alpha is 0.5?
What do the two points represent where alpha is 0.5?
 What do the two points represent where alpha is 0.5?
What do the two points represent where alpha is 0.5?
فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
79
Both H2O and OH- can act as a Brønsted acid and a Brønsted base but not as a Lewis acid.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck
80
All of the following acids have the same strength in water except
A)HNO3
B)HClO3
C)HBr
D)HF
A)HNO3
B)HClO3
C)HBr
D)HF

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 94 في هذه المجموعة.
فتح الحزمة
k this deck








