Deck 3: Stoichiometry of Formulas and Equations
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال
سؤال

فتح الحزمة
قم بالتسجيل لفتح البطاقات في هذه المجموعة!
Unlock Deck
Unlock Deck
1/87
العب
ملء الشاشة (f)
Deck 3: Stoichiometry of Formulas and Equations
1
How many atoms are in a drop of mercury that has a diameter of 1.0 mm? (Volume of a sphere is 4 r3/3; density of mercury = 13.6 g/cm3)
A) 2.1 × 1019
B) 1.7 × 1020
C) 2.1 × 1022
D) 1.7 × 1023
E) none of the above
A) 2.1 × 1019
B) 1.7 × 1020
C) 2.1 × 1022
D) 1.7 × 1023
E) none of the above
2.1 × 1019
2
Calculate the molar mass of Ca(BO2)2·6H2O.
A) 273.87 g/mol
B) 233.79 g/mol
C) 183.79 g/mol
D) 174.89 g/mol
E) 143.71 g/mol
A) 273.87 g/mol
B) 233.79 g/mol
C) 183.79 g/mol
D) 174.89 g/mol
E) 143.71 g/mol
233.79 g/mol
3
Calculate the number of oxygen atoms in 29.34 g of sodium sulfate, Na2SO4.
A) 1.244 × 1023 O atoms
B) 4.976 × 1023 O atoms
C) 2.409 × 1024 O atoms
D) 2.915 × 1024 O atoms
E) 1.166 × 1025 O atoms
A) 1.244 × 1023 O atoms
B) 4.976 × 1023 O atoms
C) 2.409 × 1024 O atoms
D) 2.915 × 1024 O atoms
E) 1.166 × 1025 O atoms
4.976 × 1023 O atoms
4
Sulfur trioxide can react with atmospheric water vapor to form sulfuric acid that falls as acid rain. Calculate the mass in grams of 3.65 × 1020 molecules of SO3.
A) 6.06 × 10-4 g
B) 2.91 × 10-2 g
C) 4.85 × 10-2 g
D) 20.6 g
E) 1650 g
A) 6.06 × 10-4 g
B) 2.91 × 10-2 g
C) 4.85 × 10-2 g
D) 20.6 g
E) 1650 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
5
A single atom of hydrogen has a mass of 1.0 amu, while a mole of hydrogen atoms has a mass of 1.0 g. Select the correct conversion factor between atomic mass units and grams.
A) 1 amu = 1 g exactly
B) 1 amu = 6.0 × 1023 g
C) 1 g = 6.0 × 1023 amu
D) 1 g = 1.7 × 10-24 amu
E) none of the above
A) 1 amu = 1 g exactly
B) 1 amu = 6.0 × 1023 g
C) 1 g = 6.0 × 1023 amu
D) 1 g = 1.7 × 10-24 amu
E) none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
6
Aluminum sulfate, Al2(SO4)3, is used in tanning leather, purifying water, and manufacture of antiperspirants. Calculate its molar mass.
A) 450.06 g/mol
B) 342.15 g/mol
C) 315.15 g/mol
D) 278.02 g/mol
E) 74.98 g/mol
A) 450.06 g/mol
B) 342.15 g/mol
C) 315.15 g/mol
D) 278.02 g/mol
E) 74.98 g/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
7
Calculate the molar mass of (NH4)3AsO4.
A) 417.80 g/mol
B) 193.03 g/mol
C) 165.02 g/mol
D) 156.96 g/mol
E) 108.96 g/mol
A) 417.80 g/mol
B) 193.03 g/mol
C) 165.02 g/mol
D) 156.96 g/mol
E) 108.96 g/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
8
What is the mass in grams of 0.250 mol of the common antacid calcium carbonate?
A) 4.00 × 102 g
B) 25.0 g
C) 17.0 g
D) 4.00 × 10-2 g
E) 2.50 × 10-3 g
A) 4.00 × 102 g
B) 25.0 g
C) 17.0 g
D) 4.00 × 10-2 g
E) 2.50 × 10-3 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
9
Calculate the number of moles in 17.8 g of the antacid magnesium hydroxide, Mg(OH)2.
A) 3.28 mol
B) 2.32 mol
C) 0.431 mol
D) 0.305 mol
E) 0.200 mol
A) 3.28 mol
B) 2.32 mol
C) 0.431 mol
D) 0.305 mol
E) 0.200 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
10
Which of the following samples contains the greatest total number atoms?
A) 50.0 g of Li2O
B) 75.0 g of CaO
C) 200.0 g of Fe2O3
D) 50.0 g of CO2
E) 100.0 g of SO3
A) 50.0 g of Li2O
B) 75.0 g of CaO
C) 200.0 g of Fe2O3
D) 50.0 g of CO2
E) 100.0 g of SO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
11
Phosphorus pentachloride, PCl5, a white solid that has a pungent, unpleasant odor, is used as a catalyst for certain organic reactions. Calculate the number of moles in 38.7 g of PCl5.
A) 5.38 mol
B) 3.55 mol
C) 0.583 mol
D) 0.282 mol
E) 0.186 mol
A) 5.38 mol
B) 3.55 mol
C) 0.583 mol
D) 0.282 mol
E) 0.186 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
12
Magnesium fluoride is used in the ceramics and glass industry. What is the mass of 1.72 mol of magnesium fluoride?
A) 43.3 g
B) 62.3 g
C) 74.5 g
D) 92.9 g
E) 107 g
A) 43.3 g
B) 62.3 g
C) 74.5 g
D) 92.9 g
E) 107 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
13
A normal breath takes in about 1.0 L of air. Assuming that air has an average molar mass of 28.8 g, and that its density is 0.97 g/L, how many molecules of air do you take in with each breath?
A) 2.0 × 1022
B) 2.2 × 1022
C) 5.8 × 1023
D) 1.7 × 1025
E) 1.8 × 1025
A) 2.0 × 1022
B) 2.2 × 1022
C) 5.8 × 1023
D) 1.7 × 1025
E) 1.8 × 1025

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
14
Potassium dichromate, K2Cr2O7, is used in tanning leather, decorating porcelain, and water proofing fabrics. Calculate the number of chromium atoms in 78.82 g of K2Cr2O7.
A) 9.490 × 1025 Cr atoms
B) 2.248 × 1024 Cr atoms
C) 1.124 × 1024 Cr atoms
D) 3.227 × 1023 Cr atoms
E) 1.613 × 1023 Cr atoms
A) 9.490 × 1025 Cr atoms
B) 2.248 × 1024 Cr atoms
C) 1.124 × 1024 Cr atoms
D) 3.227 × 1023 Cr atoms
E) 1.613 × 1023 Cr atoms

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
15
Which of the following samples has the most moles of the compound?
A) 50.0 g of Li2O
B) 75.0 g of CaO
C) 200.0 g of Fe2O3
D) 50.0 g of CO2
E) 100.0 g of SO3
A) 50.0 g of Li2O
B) 75.0 g of CaO
C) 200.0 g of Fe2O3
D) 50.0 g of CO2
E) 100.0 g of SO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
16
Calcium fluoride, CaF2, is a source of fluorine and is used to fluoridate drinking water. Calculate its molar mass.
A) 118.15 g/mol
B) 99.15 g/mol
C) 78.07 g/mol
D) 59.08 g/mol
E) 50.01 g/mol
A) 118.15 g/mol
B) 99.15 g/mol
C) 78.07 g/mol
D) 59.08 g/mol
E) 50.01 g/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
17
Calculate the molar mass of rubidium carbonate, Rb2CO3.
A) 340.43 g/mol
B) 255.00 g/mol
C) 230.94 g/mol
D) 145.47 g/mol
E) 113.48 g/mol
A) 340.43 g/mol
B) 255.00 g/mol
C) 230.94 g/mol
D) 145.47 g/mol
E) 113.48 g/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
18
Calculate the molar mass of tetraphosphorus decaoxide, P4O10, a corrosive substance which can be used as a drying agent.
A) 469.73 g/mol
B) 283.89 g/mol
C) 190.97 g/mol
D) 139.88 g/mol
E) 94.97 g/mol
A) 469.73 g/mol
B) 283.89 g/mol
C) 190.97 g/mol
D) 139.88 g/mol
E) 94.97 g/mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
19
Sodium bromate is used in a mixture which dissolves gold from its ores. Calculate the mass in grams of 4.68 mol of sodium bromate.
A) 706 g
B) 482 g
C) 383 g
D) 32.2 g
E) 0.0310 g
A) 706 g
B) 482 g
C) 383 g
D) 32.2 g
E) 0.0310 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
20
Aluminum oxide, Al2O3, is used as a filler for paints and varnishes as well as in the manufacture of electrical insulators. Calculate the number of moles in 47.51 g of Al2O3.
A) 2.377 mol
B) 2.146 mol
C) 1.105 mol
D) 0.4660 mol
E) 0.4207 mol
A) 2.377 mol
B) 2.146 mol
C) 1.105 mol
D) 0.4660 mol
E) 0.4207 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
21
Balance the following equation:
B2O3(s) + HF(l) BF3(g) + H2O(l)
A) B2O3(s) + 6HF(l) 2BF3(g) + 3H2O(l)
B) B2O3(s) + H6F6(l) B2F6(g) + H6O3(l)
C) B2O3(s) + 2HF(l) 2BF3(g) + H2O(l)
D) B2O3(s) + 3HF(l) 2BF3(g) + 3H2O(l)
E) B2O3(s) + 6HF(l) 2BF3(g) + 6H2O(l)
B2O3(s) + HF(l) BF3(g) + H2O(l)
A) B2O3(s) + 6HF(l) 2BF3(g) + 3H2O(l)
B) B2O3(s) + H6F6(l) B2F6(g) + H6O3(l)
C) B2O3(s) + 2HF(l) 2BF3(g) + H2O(l)
D) B2O3(s) + 3HF(l) 2BF3(g) + 3H2O(l)
E) B2O3(s) + 6HF(l) 2BF3(g) + 6H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
22
Household sugar, sucrose, has the molecular formula C12H22O11. What is the % of carbon in sucrose, by mass?
A) 26.7%
B) 33.3%
C) 41.4%
D) 42.1%
E) 52.8%
A) 26.7%
B) 33.3%
C) 41.4%
D) 42.1%
E) 52.8%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
23
Gadolinium oxide, a colorless powder which absorbs carbon dioxide from the air, contains 86.76 mass % Gd. Determine its empirical formula.
A) Gd2O3
B) Gd3O2
C) Gd3O4
D) Gd4O3
E) GdO
A) Gd2O3
B) Gd3O2
C) Gd3O4
D) Gd4O3
E) GdO

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
24
In the combustion analysis of 0.1127 g of glucose (C6H12O6), what mass, in grams, of CO2 would be produced?
A) 0.0451 g
B) 0.0825 g
C) 0.1652 g
D) 0.4132 g
E) 1.466 g
A) 0.0451 g
B) 0.0825 g
C) 0.1652 g
D) 0.4132 g
E) 1.466 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
25
Balance the following equation:
UO2(s) + HF(l) UF4(s) + H2O(l)
A) UO2(s) + 2HF(l) UF4(s) + H2O(l)
B) UO2(s) + 4HF(l) UF4(s) + 2H2O(l)
C) UO2 (s) + H4F4(l) UF4 (s) + H4O2(l)
D) UO2(s) + 4HF(l) UF4(s) + 4H2O(l)
E) UO2(s) + 8HF(l) 2UF4(s) + 4H2O(l)
UO2(s) + HF(l) UF4(s) + H2O(l)
A) UO2(s) + 2HF(l) UF4(s) + H2O(l)
B) UO2(s) + 4HF(l) UF4(s) + 2H2O(l)
C) UO2 (s) + H4F4(l) UF4 (s) + H4O2(l)
D) UO2(s) + 4HF(l) UF4(s) + 4H2O(l)
E) UO2(s) + 8HF(l) 2UF4(s) + 4H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
26
Hydroxylamine hydrochloride is a powerful reducing agent which is used as a polymerization catalyst. It contains 5.80 mass % H, 20.16 mass % N, 23.02 mass % O, and 51.02 mass % Cl. What is its empirical formula?
A) H2N7O8Cl18
B) H2N2O2Cl
C) HN3O4Cl9
D) H4NOCl
E) H4NOCl2
A) H2N7O8Cl18
B) H2N2O2Cl
C) HN3O4Cl9
D) H4NOCl
E) H4NOCl2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
27
Hydroxylamine nitrate contains 29.17 mass % N, 4.20 mass % H, and 66.63 mass O. If its molar mass is between 94 and 98 g/mol, what is its molecular formula?
A) NH2O5
B) N2H4O4
C) N3H3O3
D) N4H8O2
E) N2H2O4
A) NH2O5
B) N2H4O4
C) N3H3O3
D) N4H8O2
E) N2H2O4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
28
The number of hydrogen atoms in 0.050 mol of C3H8O3 is
A) 3.0 × 1022 H atoms.
B) 1.2 × 1023 H atoms.
C) 2.4 × 1023 H atoms.
D) 4.8 × 1023 H atoms.
E) none of the above.
A) 3.0 × 1022 H atoms.
B) 1.2 × 1023 H atoms.
C) 2.4 × 1023 H atoms.
D) 4.8 × 1023 H atoms.
E) none of the above.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
29
A compound containing chromium and silicon contains 73.52 mass percent chromium. Determine its empirical formula.
A) CrSi3
B) Cr2Si3
C) Cr3Si
D) Cr3Si2
E) Cr2S
A) CrSi3
B) Cr2Si3
C) Cr3Si
D) Cr3Si2
E) Cr2S

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
30
Hydroxylamine nitrate contains 29.17 mass % N, 4.20 mass % H, and 66.63 mass % O. Determine its empirical formula.
A) HNO
B) H2NO2
C) HN6O16
D) HN16O7
E) H2NO3
A) HNO
B) H2NO2
C) HN6O16
D) HN16O7
E) H2NO3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
31
Calculate the mass in grams of 8.35 × 1022 molecules of CBr4.
A) 0.0217 g
B) 0.139 g
C) 7.21 g
D) 12.7 g
E) 46.0 g
A) 0.0217 g
B) 0.139 g
C) 7.21 g
D) 12.7 g
E) 46.0 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
32
Lead (II) nitrate is a poisonous substance which has been used in the manufacture of special explosives and as a sensitizer in photography. Calculate the mass of lead in 139 g of Pb(NO3)2.
A) 107 g
B) 90.8 g
C) 87.0 g
D) 83.4 g
E) 62.6 g
A) 107 g
B) 90.8 g
C) 87.0 g
D) 83.4 g
E) 62.6 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
33
Terephthalic acid, used in the production of polyester fibers and films, is composed of carbon, hydrogen, and oxygen. When 0.6943 g of terephthalic acid was subjected to combustion analysis it produced 1.471 g CO2 and 0.226 g H2O. What is its empirical formula?
A) C2H3O4
B) C3H4O2
C) C4H3O2
D) C5H12O4
E) C2H2O
A) C2H3O4
B) C3H4O2
C) C4H3O2
D) C5H12O4
E) C2H2O

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
34
Determine the percent composition of potassium dichromate, K2Cr2O7.
A) 17.5% K, 46.6% Cr, 35.9% O
B) 29.8% K, 39.7% Cr, 30.5% O
C) 36.5% K, 48.6% Cr, 14.9% O
D) 37.2% K, 24.7% Cr, 38.1% O
E) none of the above
A) 17.5% K, 46.6% Cr, 35.9% O
B) 29.8% K, 39.7% Cr, 30.5% O
C) 36.5% K, 48.6% Cr, 14.9% O
D) 37.2% K, 24.7% Cr, 38.1% O
E) none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
35
Copper(II) sulfate pentahydrate, CuSO4·5H2O, is used as a fungicide and algicide. Calculate the mass of oxygen in 1.000 mol of CuSO4·5H2O.
A) 249.7 g
B) 144.0 g
C) 96.00 g
D) 80.00 g
E) 64.00 g
A) 249.7 g
B) 144.0 g
C) 96.00 g
D) 80.00 g
E) 64.00 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
36
Analysis of a carbohydrate showed that it consisted of 40.0 % C, 6.71 % H, and 53.3 % O by mass. Its molecular mass was found to be between 140 and 160 amu. What is the molecular formula of this compound?
A) C4H8O6
B) C5H10O5
C) C5H12O5
D) C6H12O4
E) none of the above
A) C4H8O6
B) C5H10O5
C) C5H12O5
D) C6H12O4
E) none of the above

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
37
How many protons are there in a molecule of adrenaline (C9H13NO3), a neurotransmitter and hormone?
A) 22
B) 26
C) 43
D) 98
E) 183
A) 22
B) 26
C) 43
D) 98
E) 183

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
38
Alkanes are compounds of carbon and hydrogen with the general formula CnH2n+2. An alkane component of gasoline has a molar mass of between 125 and 130 g/mol. What is the value of n for this alkane?
A) 4
B) 9
C) 10
D) 13
E) 14
A) 4
B) 9
C) 10
D) 13
E) 14

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
39
Terephthalic acid, used in the production of polyester fibers and films, is composed of carbon, hydrogen, and oxygen. When 0.6943 g of terephthalic acid was subjected to combustion analysis it produced 1.471 g CO2 and 0.226 g H2O. If its molar mass is between 158 and 167 g/mol, what is its molecular formula?
A) C4H6O7
B) C6H8O5
C) C7H12O4
D) C4H3O2
E) C8H6O4
A) C4H6O7
B) C6H8O5
C) C7H12O4
D) C4H3O2
E) C8H6O4

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
40
A compound of bromine and fluorine is used to make UF6, which is an important chemical in processing and reprocessing of nuclear fuel. The compound contains 58.37 mass percent bromine. Determine its empirical formula.
A) BrF
B) BrF2
C) Br2F3
D) Br3F
E) BrF3
A) BrF
B) BrF2
C) Br2F3
D) Br3F
E) BrF3

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
41
How many grams of oxygen are needed to react completely with 200.0 g of ammonia, NH3? 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)
A) 469.7 g
B) 300.6 g
C) 250.0 g
D) 3.406 g
E) 2.180 g
A) 469.7 g
B) 300.6 g
C) 250.0 g
D) 3.406 g
E) 2.180 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
42
Sulfur dioxide reacts with chlorine to produce thionyl chloride (used as a drying agent for inorganic halides) and dichlorine oxide (used as a bleach for wood, pulp, and textiles). SO2(g) + 2Cl2(g) SOCl2(g) + Cl2O(g)
If 0.400 mol of Cl2 reacts with excess SO2, how many moles of Cl2O are formed?
A) 0.800 mol
B) 0.400 mol
C) 0.200 mol
D) 0.100 mol
E) 0.0500 mol
If 0.400 mol of Cl2 reacts with excess SO2, how many moles of Cl2O are formed?
A) 0.800 mol
B) 0.400 mol
C) 0.200 mol
D) 0.100 mol
E) 0.0500 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
43
In a blast furnace, elemental iron is produced from a mixture of coke (C), iron ore (Fe3O4), and other reactants. An important reaction sequence is
2C(s) + O2(g) 2CO(g)
Fe3O4(s) + 4CO(g) 3Fe(l) + 4CO2(g)
How many moles of iron can be formed in this sequence when 1.00 mol of carbon, as coke, is consumed?
A) 6.00 mol Fe
B) 3.00 mol Fe
C) 1.33 mol Fe
D) 1.25 mol Fe
E) 0.750 mol Fe
2C(s) + O2(g) 2CO(g)
Fe3O4(s) + 4CO(g) 3Fe(l) + 4CO2(g)
How many moles of iron can be formed in this sequence when 1.00 mol of carbon, as coke, is consumed?
A) 6.00 mol Fe
B) 3.00 mol Fe
C) 1.33 mol Fe
D) 1.25 mol Fe
E) 0.750 mol Fe

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
44
Potassium chlorate (used in fireworks, flares, and safety matches) forms oxygen and potassium chloride when heated. KClO3(s) KCl(s) + O2(g) [unbalanced]
How many grams of oxygen are formed when 26.4 g of potassium chlorate is heated?
A) 223 g
B) 99.1 g
C) 10.3 g
D) 6.86 g
E) 4.60 g
How many grams of oxygen are formed when 26.4 g of potassium chlorate is heated?
A) 223 g
B) 99.1 g
C) 10.3 g
D) 6.86 g
E) 4.60 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
45
Aluminum will react with bromine to form aluminum bromide (used as an acid catalyst in organic synthesis). Al(s) + Br2(l) Al2Br6(s) [unbalanced]
How many moles of Al are needed to form 2.43 mol of Al2Br6?
A) 7.29 mol
B) 4.86 mol
C) 2.43 mol
D) 1.62 mol
E) 1.22 mol
How many moles of Al are needed to form 2.43 mol of Al2Br6?
A) 7.29 mol
B) 4.86 mol
C) 2.43 mol
D) 1.62 mol
E) 1.22 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
46
Phosphine, an extremely poisonous and highly reactive gas, will react with oxygen to form tetraphosphorus decaoxide and water. PH3(g) + O2(g) P4O10(s) + H2O(g) [unbalanced]
Calculate the mass of P4O10(s) formed when 225 g of PH3 reacts with excess oxygen.
A) 1880 g
B) 940. g
C) 900. g
D) 470 g
E) 56.3 g
Calculate the mass of P4O10(s) formed when 225 g of PH3 reacts with excess oxygen.
A) 1880 g
B) 940. g
C) 900. g
D) 470 g
E) 56.3 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
47
Ammonia, an important source of fixed nitrogen that can be metabolized by plants, is produced using the Haber process in which nitrogen and hydrogen combine.
N2(g) + 3H2(g) 2NH3(g)
How many grams of nitrogen are needed to produce 325 grams of ammonia?
A) 1070 g
B) 535 g
C) 267 g
D) 178 g
E) 108 g
N2(g) + 3H2(g) 2NH3(g)
How many grams of nitrogen are needed to produce 325 grams of ammonia?
A) 1070 g
B) 535 g
C) 267 g
D) 178 g
E) 108 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
48
Aluminum oxide (used as an adsorbent or a catalyst for organic reactions) forms when aluminum reacts with oxygen. 4Al(s) + 3O2(g) 2Al2O3(s)
A mixture of 82.49 g of aluminum (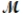 = 26.98 g/mol) and 117.65 g of oxygen (
= 26.98 g/mol) and 117.65 g of oxygen ( 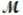 = 32.00 g/mol) is allowed to react. What mass of aluminum oxide (
= 32.00 g/mol) is allowed to react. What mass of aluminum oxide ( 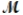 = 101.96 g/mol) can be formed?
= 101.96 g/mol) can be formed?
A) 155.8 g
B) 200.2 g
C) 249.9 g
D) 311.7 g
E) 374.9 g
A mixture of 82.49 g of aluminum (
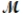 = 26.98 g/mol) and 117.65 g of oxygen (
= 26.98 g/mol) and 117.65 g of oxygen ( 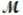 = 32.00 g/mol) is allowed to react. What mass of aluminum oxide (
= 32.00 g/mol) is allowed to react. What mass of aluminum oxide ( 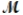 = 101.96 g/mol) can be formed?
= 101.96 g/mol) can be formed?A) 155.8 g
B) 200.2 g
C) 249.9 g
D) 311.7 g
E) 374.9 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
49
Lead(II) sulfide was once used in glazing earthenware. It will also react with hydrogen peroxide to form lead(II) sulfate and water. How many grams of hydrogen peroxide are needed to react completely with 265 g of lead(II) sulfide?
A) 151 g
B) 123 g
C) 50.3 g
D) 37.7 g
E) 9.41 g
A) 151 g
B) 123 g
C) 50.3 g
D) 37.7 g
E) 9.41 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
50
Aluminum reacts with oxygen to produce aluminum oxide which can be used as an adsorbent, desiccant, or catalyst for organic reactions. 4Al(s) + 3O2(g) 2Al2O3(s)
A mixture of 82.49 g of aluminum (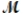 = 26.98 g/mol) and 117.65 g of oxygen (
= 26.98 g/mol) and 117.65 g of oxygen ( 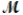 = 32.00 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
= 32.00 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
A) Oxygen is the limiting reactant; 19.81 g of aluminum remain.
B) Oxygen is the limiting reactant; 35.16 g of aluminum remain.
C) Aluminum is the limiting reactant; 16.70 g of oxygen remain.
D) Aluminum is the limiting reactant; 35.16 g of oxygen remain.
E) Aluminum is the limiting reactant; 44.24 g of oxygen remain.
A mixture of 82.49 g of aluminum (
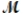 = 26.98 g/mol) and 117.65 g of oxygen (
= 26.98 g/mol) and 117.65 g of oxygen ( 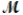 = 32.00 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
= 32.00 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.A) Oxygen is the limiting reactant; 19.81 g of aluminum remain.
B) Oxygen is the limiting reactant; 35.16 g of aluminum remain.
C) Aluminum is the limiting reactant; 16.70 g of oxygen remain.
D) Aluminum is the limiting reactant; 35.16 g of oxygen remain.
E) Aluminum is the limiting reactant; 44.24 g of oxygen remain.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
51
The iodine "clock reaction" involves the following sequence of reactions occurring in a reaction mixture in a single beaker.
1) IO3-(aq) + 5I-(aq) + 6H+(aq) 3I2(aq) + 3H2O(l)
2) I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq)
The molecular iodine (I2) formed in reaction 1 is immediately used up in reaction 2, so that no iodine accumulates. What is the overall reaction occurring in this experiment?
A)IO3-(aq) + 3I-(aq) + 2S2O32-(aq) + 6H+(aq) 2I2(aq) + S4O62-(aq) + 3H2O(l)
B)IO3-(aq) + 4S2O32-(aq) + 6H+(aq) I-(aq) + 2S4O62-(aq) + 3H2O(l)
C)IO3-(aq) + 6S2O32-(aq) + 6H+(aq) I-(aq) + 3S4O62-(aq) + 3H2O(l)
D)IO3-(aq) + I2(aq) + 8S2O32-(aq) + 6H+(aq) 3I-(aq) + 4S4O62-(aq) + 3H2O(l)
E)IO3-(aq) + 2I2(aq) + 6S2O32-(aq) + 6H+(aq) 5I-(aq) + 3S4O62-(aq) + 3H2O(l)
1) IO3-(aq) + 5I-(aq) + 6H+(aq) 3I2(aq) + 3H2O(l)
2) I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq)
The molecular iodine (I2) formed in reaction 1 is immediately used up in reaction 2, so that no iodine accumulates. What is the overall reaction occurring in this experiment?
A)IO3-(aq) + 3I-(aq) + 2S2O32-(aq) + 6H+(aq) 2I2(aq) + S4O62-(aq) + 3H2O(l)
B)IO3-(aq) + 4S2O32-(aq) + 6H+(aq) I-(aq) + 2S4O62-(aq) + 3H2O(l)
C)IO3-(aq) + 6S2O32-(aq) + 6H+(aq) I-(aq) + 3S4O62-(aq) + 3H2O(l)
D)IO3-(aq) + I2(aq) + 8S2O32-(aq) + 6H+(aq) 3I-(aq) + 4S4O62-(aq) + 3H2O(l)
E)IO3-(aq) + 2I2(aq) + 6S2O32-(aq) + 6H+(aq) 5I-(aq) + 3S4O62-(aq) + 3H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
52
Balance the following equation for the combustion of benzene:
C6H6(l) + O2(g) H2O(g) + CO2(g)
A) C6H6(l) + 9O2(g) 3H2O(g) + 6CO2(g)
B) C6H6(l) + 9O2(g) 6H2O(g) + 6CO2(g)
C) 2C6H6(l) + 15O2(g) 6H2O(g) + 12CO2(g)
D) C6H6(l) + 15O2(g) 3H2O(g) + 6CO2(g)
E) 2C6H6(l) + 9O2(g) 6H2O(g) + 12CO2(g)
C6H6(l) + O2(g) H2O(g) + CO2(g)
A) C6H6(l) + 9O2(g) 3H2O(g) + 6CO2(g)
B) C6H6(l) + 9O2(g) 6H2O(g) + 6CO2(g)
C) 2C6H6(l) + 15O2(g) 6H2O(g) + 12CO2(g)
D) C6H6(l) + 15O2(g) 3H2O(g) + 6CO2(g)
E) 2C6H6(l) + 9O2(g) 6H2O(g) + 12CO2(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
53
How many grams of sodium fluoride (used in water fluoridation and manufacture of insecticides) are needed to form 485 g of sulfur tetrafluoride?
3SCl2(l) + 4NaF(s) SF4(g) + S2Cl2(l) + 4NaCl(s)
A) 1940 g
B) 1510 g
C) 754 g
D) 205 g
E) 51.3 g
3SCl2(l) + 4NaF(s) SF4(g) + S2Cl2(l) + 4NaCl(s)
A) 1940 g
B) 1510 g
C) 754 g
D) 205 g
E) 51.3 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
54
Balance the following equation:
Ca3(PO4)2(s) + SiO2(s) + C(s) CaSiO3(s) + CO(g) + P4(s)
A) Ca3(PO4)2(s) + 3SiO2(s) + 8C(s) 3CaSiO3(s) + 8CO(g) + P4(s)
B) Ca3(PO4)2(s) + 3SiO2(s) + 14C(s) 3CaSiO3(s) + 14CO(g) + P4(s)
C) Ca3(PO4)2(s) + 3SiO2(s) + 8C(s) 3CaSiO3(s) + 8CO(g) + 2P4(s)
D) 2Ca3(PO4)2(s) + 6SiO2(s) + 10C(s) 6CaSiO3(s) + 10CO(g) + P4(s)
E) 2Ca3(PO4)2(s) + 6SiO2(s) + 10C(s) 6CaSiO3(s) + 10CO(g) + 4P4(s)
Ca3(PO4)2(s) + SiO2(s) + C(s) CaSiO3(s) + CO(g) + P4(s)
A) Ca3(PO4)2(s) + 3SiO2(s) + 8C(s) 3CaSiO3(s) + 8CO(g) + P4(s)
B) Ca3(PO4)2(s) + 3SiO2(s) + 14C(s) 3CaSiO3(s) + 14CO(g) + P4(s)
C) Ca3(PO4)2(s) + 3SiO2(s) + 8C(s) 3CaSiO3(s) + 8CO(g) + 2P4(s)
D) 2Ca3(PO4)2(s) + 6SiO2(s) + 10C(s) 6CaSiO3(s) + 10CO(g) + P4(s)
E) 2Ca3(PO4)2(s) + 6SiO2(s) + 10C(s) 6CaSiO3(s) + 10CO(g) + 4P4(s)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
55
Aluminum metal reacts with chlorine gas to form solid aluminum trichloride, AlCl3. What mass of chlorine gas is needed to react completely with 163 g of aluminum?
A) 214 g
B) 245 g
C) 321 g
D) 489 g
E) 643 g
A) 214 g
B) 245 g
C) 321 g
D) 489 g
E) 643 g

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
56
Ammonia will react with fluorine to produce dinitrogen tetrafluoride and hydrogen fluoride (used in production of aluminum, in uranium processing, and in frosting of light bulbs). 2NH3(g) + 5F2(g) N2F4(g) + 6HF(g)
How many moles of NH3 are needed to react completely with 13.6 mol of F2?
A) 34.0 mol
B) 27.2 mol
C) 6.80 mol
D) 5.44 mol
E) 2.27 mol
How many moles of NH3 are needed to react completely with 13.6 mol of F2?
A) 34.0 mol
B) 27.2 mol
C) 6.80 mol
D) 5.44 mol
E) 2.27 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
57
Balance the following equation:
C8H18O3(l) + O2(g) H2O(g) + CO2(g)
A) C8H18O3(l) + 8O2(g) 9H2O(g) + 8CO2(g)
B) C8H18O3(l) + 11O2(g) 9H2O(g) + 8CO2(g)
C) 2C8H18O3(l) + 22O2(g) 9H2O(g) + 16CO2(g)
D) C8H18O3(l) + 13O2(g) 18H2O(g) + 8CO2(g)
E) 2C8H18O3(l) + 17O2(g) 18H2O(g) + 16CO2(g)
C8H18O3(l) + O2(g) H2O(g) + CO2(g)
A) C8H18O3(l) + 8O2(g) 9H2O(g) + 8CO2(g)
B) C8H18O3(l) + 11O2(g) 9H2O(g) + 8CO2(g)
C) 2C8H18O3(l) + 22O2(g) 9H2O(g) + 16CO2(g)
D) C8H18O3(l) + 13O2(g) 18H2O(g) + 8CO2(g)
E) 2C8H18O3(l) + 17O2(g) 18H2O(g) + 16CO2(g)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
58
How many molecules of molecular oxygen react with four molecules of NH3 to form four molecules of nitrogen monoxide and six molecules of water?
A) 2
B) 10
C) 3
D) 4
E) 5
A) 2
B) 10
C) 3
D) 4
E) 5

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
59
The iodine "clock reaction" involves the following sequence of reactions occurring in a reaction mixture in a single beaker.
1) IO3-(aq) + 5I-(aq) + 6H+(aq) 3I2(aq) + 3H2O(l)
2) I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq)
The molecular iodine (I2) formed in reaction 1 is immediately used up in reaction 2, so that no iodine accumulates. In one experiment, a student made up a reaction mixture which initially contained 0.0020 mol of iodate ions (IO3-). If the iodate ions reacted completely, how many moles of thiosulfate ions (S2O32-) were needed in reaction 2, in order to react completely with the iodine (I2) produced in reaction 1?
A)0)0020 mol
B)0)0030 mol
C)0)0040 mol
D)0)0050 mol
E)0)0060 mol
1) IO3-(aq) + 5I-(aq) + 6H+(aq) 3I2(aq) + 3H2O(l)
2) I2(aq) + 2S2O32-(aq) 2I-(aq) + S4O62-(aq)
The molecular iodine (I2) formed in reaction 1 is immediately used up in reaction 2, so that no iodine accumulates. In one experiment, a student made up a reaction mixture which initially contained 0.0020 mol of iodate ions (IO3-). If the iodate ions reacted completely, how many moles of thiosulfate ions (S2O32-) were needed in reaction 2, in order to react completely with the iodine (I2) produced in reaction 1?
A)0)0020 mol
B)0)0030 mol
C)0)0040 mol
D)0)0050 mol
E)0)0060 mol

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
60
An important reaction sequence in the industrial production of nitric acid is the following: N2(g) + 3H2(g) 2NH3(g)
4NH3(g) + 5O2(g) 4NO(g) + 6H2O(l)
Starting from 20.0 mol of nitrogen gas in the first reaction, how many moles of oxygen gas are required in the second one?
A) 12.5 mol O2
B) 20.0 mol O2
C) 25.0 mol O2
D) 50.0 mol O2
E)100. mol O2
4NH3(g) + 5O2(g) 4NO(g) + 6H2O(l)
Starting from 20.0 mol of nitrogen gas in the first reaction, how many moles of oxygen gas are required in the second one?
A) 12.5 mol O2
B) 20.0 mol O2
C) 25.0 mol O2
D) 50.0 mol O2
E)100. mol O2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
61
Analysis of a white solid produced in a reaction between chlorine and phosphorus showed that it contained 77.44% chlorine and 22.56% phosphorus. What is its empirical formula?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
62
One mole of O2 has a mass of 16.0 g.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
63
What is the percent yield for the reaction PCl3(g) + Cl2(g) PCl5(g)
If 119.3 g of PCl5 (M = 208.2 g/mol) are formed when 61.3 g of Cl2 (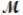 = 70.91 g/mol) react with excess PCl3?
= 70.91 g/mol) react with excess PCl3?
A) 195%
B) 85.0%
C) 66.3%
D) 51.4%
E) 43.7%
If 119.3 g of PCl5 (M = 208.2 g/mol) are formed when 61.3 g of Cl2 (
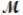 = 70.91 g/mol) react with excess PCl3?
= 70.91 g/mol) react with excess PCl3?A) 195%
B) 85.0%
C) 66.3%
D) 51.4%
E) 43.7%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
64
For a sample consisting of 2.50 g of methane, CH4, calculate
a. the number of moles of methane present.
b. the total number of atoms present.
a. the number of moles of methane present.
b. the total number of atoms present.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
65
Magnesium (used in the manufacture of light alloys) reacts with iron(III) chloride to form magnesium chloride and iron. 3Mg(s) + 2FeCl3(s) 3MgCl2(s) + 2Fe(s)
A mixture of 41.0 g of magnesium (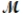 = 24.31 g/mol) and 175 g of iron(III) chloride (
= 24.31 g/mol) and 175 g of iron(III) chloride ( 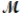 = 162.2 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
= 162.2 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
A) Limiting reactant is Mg; 67 g of FeCl3 remain.
B) Limiting reactant is Mg; 134 g of FeCl3 remain.
C) Limiting reactant is Mg; 104 g of FeCl3 remain.
D) Limiting reactant is FeCl3; 2 g of Mg remain.
E) Limiting reactant is FeCl3; 87 g of Mg remain.
A mixture of 41.0 g of magnesium (
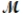 = 24.31 g/mol) and 175 g of iron(III) chloride (
= 24.31 g/mol) and 175 g of iron(III) chloride ( 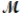 = 162.2 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.
= 162.2 g/mol) is allowed to react. Identify the limiting reactant and determine the mass of the excess reactant present in the vessel when the reaction is complete.A) Limiting reactant is Mg; 67 g of FeCl3 remain.
B) Limiting reactant is Mg; 134 g of FeCl3 remain.
C) Limiting reactant is Mg; 104 g of FeCl3 remain.
D) Limiting reactant is FeCl3; 2 g of Mg remain.
E) Limiting reactant is FeCl3; 87 g of Mg remain.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
66
Ammonia, NH3, is produced industrially from nitrogen and hydrogen as follows:
N2(g) + 3H2(g) 2NH3(g)
What mass, of which starting material, will remain when 30.0 g of N2 and 10.0 g of H2 react until the limiting reagent is completely consumed?
N2(g) + 3H2(g) 2NH3(g)
What mass, of which starting material, will remain when 30.0 g of N2 and 10.0 g of H2 react until the limiting reagent is completely consumed?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
67
Gaseous methanol (CH4O) reacts with oxygen gas to produce carbon dioxide gas and liquid water. Write a balanced equation for this process.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
68
Balance the equation
B2O3(s) + NaOH(aq) Na3BO3(aq) + H2O(l)
B2O3(s) + NaOH(aq) Na3BO3(aq) + H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
69
In 0.20 mole of phosphoric acid, H3PO4
a. how many H atoms are there?
b. what is the total number of atoms?
c. how many moles of O atoms are there?
a. how many H atoms are there?
b. what is the total number of atoms?
c. how many moles of O atoms are there?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
70
Methanol (CH4O) is converted to bromomethane (CH3Br) as follows:
CH4O + HBr CH3Br + H2O
If 12.23 g of bromomethane are produced when 5.00 g of methanol is reacted with excess HBr, what is the percentage yield?
A) 40.9%
B) 82.6%
C) 100.%
D) 121%
E) 245%
CH4O + HBr CH3Br + H2O
If 12.23 g of bromomethane are produced when 5.00 g of methanol is reacted with excess HBr, what is the percentage yield?
A) 40.9%
B) 82.6%
C) 100.%
D) 121%
E) 245%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
71
Tetraphosphorus hexaoxide ( 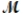 = 219.9 g/mol) is formed by the reaction of phosphorus with oxygen gas. P4(s) + 3O2(g) P4O6(s)
= 219.9 g/mol) is formed by the reaction of phosphorus with oxygen gas. P4(s) + 3O2(g) P4O6(s)
If a mixture of 75.3 g of phosphorus and 38.7 g of oxygen produce 43.3 g of P4O6, what is the percent yield for the reaction?
A) 57.5%
B) 48.8%
C) 38.0%
D) 32.4%
E) 16.3%
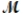 = 219.9 g/mol) is formed by the reaction of phosphorus with oxygen gas. P4(s) + 3O2(g) P4O6(s)
= 219.9 g/mol) is formed by the reaction of phosphorus with oxygen gas. P4(s) + 3O2(g) P4O6(s)If a mixture of 75.3 g of phosphorus and 38.7 g of oxygen produce 43.3 g of P4O6, what is the percent yield for the reaction?
A) 57.5%
B) 48.8%
C) 38.0%
D) 32.4%
E) 16.3%

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
72
Consider the balanced equation for the combustion of propane, C3H8
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
If propane reacts with oxygen as above
a. what is the limiting reagent in a mixture containing 5.00 g of C3H8 and 10.0 g of O2?
b. what mass of CO2 is formed when 1.00 g of C3H8 reacts completely?
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
If propane reacts with oxygen as above
a. what is the limiting reagent in a mixture containing 5.00 g of C3H8 and 10.0 g of O2?
b. what mass of CO2 is formed when 1.00 g of C3H8 reacts completely?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
73
The insecticide DDT was formerly in widespread use, but now it is severely restricted owing to its adverse environmental effects. It is prepared as follows:
C2HCl3O + 2C6H5Cl C14H9Cl5 + H2O
chloral chlorobenzene DDT
If 10.00 g of chloral were reacted with 10.00 g of chlorobenzene
a. what is the maximum amount (mol) of DDT which could be formed?
b. what is the limiting reagent?
c. what is the % yield, if 12.15 g of DDT is produced?
C2HCl3O + 2C6H5Cl C14H9Cl5 + H2O
chloral chlorobenzene DDT
If 10.00 g of chloral were reacted with 10.00 g of chlorobenzene
a. what is the maximum amount (mol) of DDT which could be formed?
b. what is the limiting reagent?
c. what is the % yield, if 12.15 g of DDT is produced?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
74
A compound consisting of C, H, and O only, has a molar mass of 331.5 g/mol. Combustion of 0.1000 g of this compound caused a 0.2921 g increase in the mass of the CO2 absorber and a 0.0951 g increase in the mass of the H2O absorber. What is the empirical formula of the compound?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
75
Balance the following equation for the combustion of butane, a hydrocarbon used in gas lighters:
C4H10(g) + O2(g) CO2(g) + H2O(l)
C4H10(g) + O2(g) CO2(g) + H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
76
Balance the following equation for partial oxidation of ammonia, an important reaction in the production of nitric acid:
NH3(g) + O2(g) NO(g) + H2O(l)
NH3(g) + O2(g) NO(g) + H2O(l)

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
77
Potassium chloride is used as a substitute for sodium chloride for individuals with high blood pressure. Identify the limiting reactant and determine the mass of the excess reactant remaining when 7.00 g of chlorine gas reacts with 5.00 g of potassium to form potassium chloride.
A) Potassium is the limiting reactant; 2.47 g of chlorine remain.
B) Potassium is the limiting reactant; 7.23 g of chlorine remain.
C) Chlorine is the limiting reactant; 4.64 g of potassium remain.
D) Chlorine is the limiting reactant; 2.70 g of potassium remain.
E) No limiting reagent: the reactants are present in the correct stoichiometric ratio.
A) Potassium is the limiting reactant; 2.47 g of chlorine remain.
B) Potassium is the limiting reactant; 7.23 g of chlorine remain.
C) Chlorine is the limiting reactant; 4.64 g of potassium remain.
D) Chlorine is the limiting reactant; 2.70 g of potassium remain.
E) No limiting reagent: the reactants are present in the correct stoichiometric ratio.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
78
Propane, C3H8, is commonly provided as a bottled gas for use as a fuel. In 0.200 mol of propane
a. what is the mass of propane?
b. what mass of carbon is present?
c. how many molecules of C3H8 are present?
d. how many hydrogen atoms are present?
a. what is the mass of propane?
b. what mass of carbon is present?
c. how many molecules of C3H8 are present?
d. how many hydrogen atoms are present?

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
79
Magnesium reacts with iron(III) chloride to form magnesium chloride (which can be used in fireproofing wood and in disinfectants) and iron. 3Mg(s) + 2FeCl3(s) 3MgCl2(s) + 2Fe(s)
A mixture of 41.0 g of magnesium (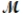 = 24.31 g/mol) and 175 g of iron(III) chloride (
= 24.31 g/mol) and 175 g of iron(III) chloride ( 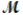 = 162.2 g/mol) is allowed to react. What mass of magnesium chloride = 95.21 g/mol) is formed?
= 162.2 g/mol) is allowed to react. What mass of magnesium chloride = 95.21 g/mol) is formed?
A) 68.5 g MgCl2
B) 77.0 g MgCl2
C) 71.4 g MgCl2
D) 107 g MgCl2
E) 154 g MgCl2
A mixture of 41.0 g of magnesium (
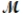 = 24.31 g/mol) and 175 g of iron(III) chloride (
= 24.31 g/mol) and 175 g of iron(III) chloride ( 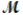 = 162.2 g/mol) is allowed to react. What mass of magnesium chloride = 95.21 g/mol) is formed?
= 162.2 g/mol) is allowed to react. What mass of magnesium chloride = 95.21 g/mol) is formed?A) 68.5 g MgCl2
B) 77.0 g MgCl2
C) 71.4 g MgCl2
D) 107 g MgCl2
E) 154 g MgCl2

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck
80
Consider the balanced equation:
Al2S3(s) + 6H2O(l) 2Al(OH)3(s) + 3H2S(g)
If 15.0g of aluminum sulfide and 10.0g of water are allowed to react as above, and assuming a complete reaction
a. by calculation, find out which is the limiting reagent.
b. calculate the maximum mass of H2S which can be formed from these reagents.
c. calculate the mass of excess reagent remaining after the reaction is complete.
Al2S3(s) + 6H2O(l) 2Al(OH)3(s) + 3H2S(g)
If 15.0g of aluminum sulfide and 10.0g of water are allowed to react as above, and assuming a complete reaction
a. by calculation, find out which is the limiting reagent.
b. calculate the maximum mass of H2S which can be formed from these reagents.
c. calculate the mass of excess reagent remaining after the reaction is complete.

فتح الحزمة
افتح القفل للوصول البطاقات البالغ عددها 87 في هذه المجموعة.
فتح الحزمة
k this deck








